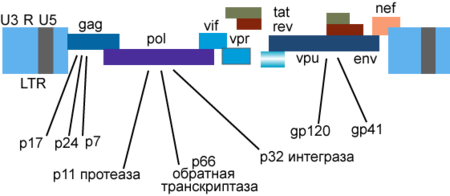Вірус імунодефіциту людини
| Вірус імунодефіциту людини | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 Стилізоване зображення ВІЛ
| ||||||||||
| Класифікація вірусів | ||||||||||
| ||||||||||
|
Посилання
| ||||||||||
|
Ві́рус імунодефіци́ту люди́ни або ВІЛ (англ. Human Immunodeficiency Virus, HIV) — два види вірусів роду лентивірусів родини ретровірусів), які уражають людину. Спричинюють таку хворобу, як ВІЛ-інфекція, термінальною стадією якої є синдром набутого імунного дефіциту (СНІД), при якому імунна система організма втрачає можливість захищати хворого від ВІЛ-асоційованих хвороб: деяких пухлин та опортуністичних інфекцій, не типових для здорової людини. Без лікування смерть від СНІДу настає у 100% випадків. У середньому, людина з ВІЛ-інфекцією, яка не отримує специфічного лікування, помирає через 9-11 років після зараження (залежно від виду вірусу). Високоактивна антиретровірусна терапія дозволяє значно збільшити тривалість життя.
Передається статевим шляхом через прямий контакт слизових оболонок або крові з рідиною тілесного походження, яка містить ВІЛ, як-от кров, сперма, вагінальні виділення, смегма. Нестатевим шляхом вірус може передаватися від матері до дитини (під час вагітності, пологів або годування грудним молоком), а також внаслідок використання нестерильних медичних інструментів. У різних тілесних рідинах вірус представлений і вільними частинками, і зараженими клітинами.
Вірус уражає клітини імунної системи, що мають на своїй поверхні рецептори CD4: Т-хелпери, моноцити, макрофаги, клітини Лангерганса, дендритні клітини, клітини мікроглії. Коли рівень клітин із CD4 падає нижче критичного рівня, клітинний імунітет втрачається і організм стає все більше сприйнятливий до розвитку опортуністичних інфекцій, що призводить до СНІДу.
Зміст
Історичні відомості
Походження

Вважають, що обидва типи вірусу імунодефіциту людини ВІЛ-1 і ВІЛ-2 виникли в західних і центральних регіонах Субсахарської Африки і передалися від мавп до людей внаслідок прориву міжвидових бар'єрів.
ВІЛ-1 виник на півдні Камеруну внаслідок еволюції ендемічного вірусу імунодефіциту мавп SIV-cpz, який заражає диких шимпанзе (підвиду Pan troglodytes troglodytes).
ВІЛ-2 виник на території Західної Африки (від південного Сенегалу до заходу Кот-д'Івуару) внаслідок еволюції вірусу імунодефіциту мавп SIV-smm, який заражає темно-коричневих мангабеїв (Cercocebus atys) і вузьконосих мавп. Проте деякі широконосі мавпи, такі як нічні мавпи, є стійкими до ВІЛ-1, можливо, через геномне злиття двох вірусних генів стійкості. ВІЛ-1, як вважають, перестрибнув видовий бар'єр, принаймні тричі, і породив три групи вірусів: M, N і О.
Існує доказ того, що мисливці на диких тварин (мавп) або постачальники м'яса в Західній і Центральній Африці заражаються вірусом імунодефіциту мавп, причому ймовірність зараження корелює з частотою контактів з мавпами і їх м'ясом. Однак імунна система людини зазвичай пригнічує цей вірус упродовж тижня після зараження. Вважають, що потрібно було декілька передач вірусу від людини до людини в швидкій послідовності, щоб вірусу вистачило часу мутувати у ВІЛ. Хоча передавання вірусу імунодефіциту мавп від людини до людини відбувається рідко, певні соціальні чинники можуть суттєво впливати на частоту заражень. Припускають, що умови для поширення вірусу були несприятливі в Африці до XX століття. Зіставлення періодів прискореної еволюції ВІЛ з соціоекономічними змінами дозволяє робити припущення про природу чинників, що прискорили поширення ВІО і ВІЛ.
Генетичні дослідження показують, що останній спільний предок ВІЛ-1 групи М існував близько 1910 року. Прихильники цієї дати пов'язують поширення ВІЛ з розвитком колоніалізму і зростанням великих колоніальних африканських міст. Ці чинники призвели до соціальних змін у суспільстві, як-от збільшення частоти безладних сексуальних відносин, поширення проституції та захворювань, що передаються статевим шляхом. ЗПСШ, наприклад, сифіліс, можуть супроводжуватися генітальними виразками. Дослідження показують, що ймовірність передачі ВІЛ під час вагінального статевого акту, досить низька за звичайних умов, може збільшитись у десятки, якщо не сотні разів, коли один з партнерів потерпає від генітальних виразок. Про ступінь поширеності ЗПСШ у колоніальних містах на початку 1900-х можна судити з таких цифр: 1928 року щонайменше 45 % мешканок східного Леопольдвіля (нині — Кіншаса, ранній центр поширення ВІЛ групи М) були у проституції, а станом на 1933 рік близько 15 % усіх мешканців цього ж міста були заражені однією з форм сифілісу. Ретроспективний аналіз показав, що початок епідемії ВІЛ-інфекції в Кіншасі збігся з піком епідемії генітальних виразок у середині 1930-х.
Згідно з альтернативним поглядом, основним чинником, що сприяв адаптації ВІЛ до людей і його поширенню, була небезпечна медична практика в Африці в роки після Другої світової війни, як-от використання нестерильних багаторазових шприців під час масових вакцинацій, ін'єкції антибіотиків і протималярійних засобів.
Під час ретроаналізу зразків крові, взятих після Другої світової війни, зафіксовано найбільш ранній документальний випадок наявності ВІЛ в організмі людини, кров у якої взяли 1959 року. Вірус, можливо, циркулював у США уже в 1966 році, але переважну більшість випадків зараження ВІЛ, ідентифікованих за межами Субсахарської Африки, можна простежити до однієї невстановленої особи, яка заразилась ВІЛ на Гаїті, а потім перенесла цю інфекцію в США близько 1969 року.
Ще одна теорія припускає, що тривала, але нечисленна неепідемічна циркуляція ВІЛ серед людей в Африці до 1970-х не мала епідемічного характеру через поширення там натуральної віспи, яка була вкрай смертельною хворобою і досить швидко винищувала багато носіїв ВІЛ. Однак після глобальної ерадикації натуральної віспи у цей період виживаність хворих на ВІЛ-інфекцію стала тривалішою, можливості передачі вірусу збільшилися, циркуляція ВІЛ в Африці стала безперешкодною та досягла епідемічного характеру, а звідти й поширилася по світу зрештою як пандемія.
Відкриття
Взимку 1981 року до госпіталю Нью-Йоркського університету поступило декілька молодих чоловіків, близько 30 років, з незвичайною клінічною формою саркоми Капоші. У той час це захворювання траплялося досить рідко: всього 1-2 випадки на 10 мільйонів населення, переважно в людей літнього віку. Саркома мала злоякісний перебіг: пухлини поширювалися по всьому тілу, виявлялися на слизових оболонках, не піддавалися лікуванню й швидко призводили до смерті.
Навесні 1981 року в Лос-Анджелесі з'явилася ще одна категорія незвичайних хворих — зі злоякісною формою пневмоцистної пневмонії. У 3-х з них пневмоцистне запалення легень супроводжувалося кандидозом.
Влітку 1981 р. у Центр контролю за захворюваннями США в Атланті (штат Джоджія) надійшла інформація вже про 111 пацієнтів із таким захворюванням. Майже усі вони виникли у чоловіків молодого віку і усі ці особи були геями. Висока смертність спонукала організувати обов'язковий облік, спостереження й вивчення усіх випадків нової хвороби.
Появу цих захворювань у молодих людей, що не належать до відповідних груп ризику, спостерігали вперше. Потім виявили такі ж симптоми серед наркоспоживачів, хворих на гемофілію A і гаїтян. Найбільш значущим було виявлення зниження співвідношення CD4+/CD8+-клітин внаслідок відносного і/або абсолютного зменшення кількості CD4+-лімфоцитів у поєднанні зі збільшенням кількості CD8+-лімфоцитів.
Літо 1981 року заведено вважати початком глобальної епідемії ВІЛ-інфекції / СНІДу. Ретроспективний аналіз сироваток, що зберігалися в Національному Центрі контролю за інфекційними захворюваннями у США, показав, що перші випадки СНІДу людини припали на 1950-ті роки, захворювання виникло в Африці, а потім поширилося на території інших країн.
Основою раніше невідомого захворювання було різке ослаблення імунітету. У липні 1982 року для позначення цього стану запропоновано термін «синдром набутого імунного дефіциту» (СНІД, AIDS). У вересні 1982 року СНІДу дали повноцінне визначення як нозологічній формі на підставі спостереження низки опортуністичних інфекцій у чотирьох груп пацієнтів, зазначених вище.
У період з 1981 по 1984 рік вийшло кілька робіт, що пов'язували ймовірність розвитку ВІЛ-інфекції / СНІДу з анальним сексом або з впливом наркотиків. Паралельно йшли роботи над гіпотезою про можливу інфекційну природу СНІДу.
Вірус імунодефіциту людини незалежно відкрили 1983 року в двох лабораторіях: у Інституті Пастера у Франції під керівництвом Люка Монтаньє і в Національному інституті раку в США під керівництвом Роберта Галло. Результати досліджень, у яких із тканин пацієнтів із симптомами СНІДу вперше вдалося виділити новий ретровірус, опубліковано 20 травня 1983 року в журналі Science. У цих же роботах виділений з хворих на СНІД вірус був вперше успішно розмножили у культивованих Т-лімфоцитах. Французька дослідницька група показала, що серологічно цей вірус відрізняється від HTLV-I, і назвала його LAV («вірус, асоційований з лімфаденопатією»), а американська група назвала його HTLV-III, помилково віднісши до групи HTLV-вірусів. Вчені висунули припущення, що вірус може викликати синдром набутого імунного дефіциту.
1986 року виявлено, що віруси, відкриті 1983-го французькими та американськими вченими, генетично ідентичні. Початкові назви вірусів скасовано і запропоновано одну спільну назву — вірус імунодефіциту людини. 2008 року Люк Монтаньє і Франсуаза Барр-Сінуссі ушановані Нобелівської премії в області фізіології або медицини «за відкриття вірусу імунодефіциту людини».
ВІЛ-інфекція
Інфікування
Вірус може передаватися через прямий контакт пошкодженої або непошкодженої слизової оболонки або пошкодженої шкіри здорової людини з біологічними рідинами зараженої людини: кров'ю, передеякулятом (виділяється протягом всього статевого акту), спермою, вагінальним секретом, грудним молоком. Вірус може передаватись під час незахищеного анального, вагінального або орального сексу.
Інтактна (неушкоджена) шкіра є ефективним бар'єром для інфекції, тому що в шкірі відсутні клітини, які можуть бути заражені ВІЛ. Для успішного інфікування потрібен прямий контакт з кровоносною системою або з мембранами клітин слизових оболонок. Під час статевого акту слизові оболонки геніталій і прямої кишки часто зазнають незначних пошкоджень, через які вірус може потрапляти в кров. Такі пошкодження частіше виникають за наявності ІПСШ, наприклад, у разі простого герпесу. Тому особливо небезпечною формою статевого акту для приймаючого партнера (партнерки) є незахищений анальний секс, бо за цієї форми виникає найбільша кількість дрібних і великих пошкоджень. З іншого боку, зараження можливе і в разі непошкодженої слизової оболонки, оскільки слизова оболонка містить значну кількість дендритних клітин (зокрема, клітин Лангерганса), які можуть відігравати роль «носіїв» вірусних частинок у лімфатичні вузли.
З більшою ймовірністю вірус передається внаслідок використання заражених голок і шприців (особливо споживачами ін'єкційних наркотиків), а також під час переливання крові (якщо медичний персонал порушив встановлені процедури перевірки донорської крові). Також вірус може передатись від матері до дитини під час вагітності, пологів (зараження через кров матері) та під час грудного вигодовування (причому і від зараженої матері до здорової дитини через грудне молоко, і від зараженої дитини до здорової матері внаслідок покусування грудей під час годування).
Вірус не передається повітряно-крапельним шляхом, побутовим шляхом, стикаючись з непошкодженою шкірою, через укуси більшості кровосисних комах (виняток мухи-жигалки), сльози і слину (через те, що концентрація віріонів ВІЛ у цих рідинах нижча за інфікувальну дозу, а також завдяки тому, що слина — агресивне середовище, руйнує своїми ферментами віріони ВІЛ).
Хвороба
У перебігу хвороби виділяють три стадії: гостру інфекцію, латентний період і термінальну стадію (СНІД) (див. ілюстрацію). У ході розвитку ВІЛ-інфекції в однієї й тієї ж людини внаслідок мутацій виникають нові штами вірусу, які різняться за швидкістю відтворення та здатністю інфікувати. Розмножившись, вірусні частинки вивільняються з уражених клітин і впроваджуються в нові — цикл розвитку повторюється. Інфіковані вірусом Т-хелпери поступово гинуть через руйнування вірусом, апоптозу або знищення Т-кілерами. У процесі розвитку ВІЛ-інфекції кількість Т-хелперів (CD4+-клітин) знижується настільки, що організм вже не може протистояти збудників опортуністичних інфекцій, які безпечні або мало небезпечні для здорових людей з нормально функціонуючою імунною системою. На термінальній стадії (СНІД) ослаблений організм вражають бактеріальні, грибкові, вірусні і протозойні інфекції, а також пухлини. У відсутність антиретровірусної терапії смерть настає не в результаті розмноження вірусу в CD4+-клітинах, а з причини розвитку опортуністичних захворювань (вторинних по відношенню до ВІЛ-інфекції).
Епідеміологія

Згідно з доповіддю «Об'єднаної програми ООН по ВІЛ/СНІД» 2008 р.
- Кількість людей, які живуть з ВІЛ/СНІД, у 2008 р.
- Усього — 39,5 мільйона (34,1 — 47,1 мільйона).
- Дорослих — 37,2 мільйона (32,1 — 44,5 мільйона).
- Жінок — 17,7 мільйона (15,1 — 20,9 мільйона).
- Дітей до 15 років — 2,3 мільйона (1,7 — 3,5 мільйона)
- Кількість людей, які заразилися ВІЛ у 2008 р.
- Усього — 4,3 мільйона (3,6 — 6,6 мільйона).
- Дорослих — 3,8 мільйона (3,2 — 5,7 мільйона).
- Дітей до 15 років — 530,000 (410,000 — 660,000)
- Кількість смертей від СНІД у 2008 р.
- Усього — 2,9 мільйона (2,5 — 3,5 мільйона).
- Дорослих — 2,6 мільйона (2,2 — 3,0 мільйона).
- Дітей до 15 років — 380,000 (290,000 — 500,000)
При цьому з загальної кількості інфікованих дві третини (63 % — 24,7 млн. [21,8 — 27,7 млн.]) усіх дорослих та дітей з ВІЛ у світі живуть в країнах Африки на південь від пустелі Сахара, переважно у Південній Африці. Одна третина (32 %) усіх людей з ВІЛ у світі живе в цьому регіоні, і тут також сталися 34 % усіх смертей від СНІДу 2008 році.
19 липня 2016 року Американський Інститут показників і оцінки здоров'я оприлюднив дослідження щодо інфікування ВІЛ та захворювання на СНІД у 2005 — 2015 роках, у якому на тлі глобальних успіхів Україна показала невтішну статистику. Показники смертності від захворювання на СНІД на глобальному рівні скорочуються. Про це йдеться у звіті американського Інституту показників і оцінки здоров'я (англ. IHME). Водночас, зазначається в документі, в окремих країнах за минуле десятиріччя показники нових інфікувань ВІЛ суттєво зросли. Серед країн найбільшу кількість випадків нових інфікувань зафіксували у Росії (57 340) та Україні (13 490).
Серед світових антилідерів за зростанням відносного показника нових захворювань у 2005—2015 роках опинилися також Єгипет, Пакистан, Кенія, Філіппіни, Мексика та Камбоджа. Загалом кількість нових інфікувань за 10 років в середньому падала лише на 0,7 % на рік у порівнянні з річним спадом на 2,7 % у 1997—2005 роках. Вчені занепокоєні, що через це світові зусилля з подолання пандемії СНІДу до 2030 року можуть зійти нанівець.
За даними на 2011 рік, у світі за весь час на ВІЛ-інфекцію захворіли 60 мільйонів осіб, з них: 25 мільйонів померли, а 35 мільйонів живуть з ВІЛ-інфекцією. Понад дві третини з них мешкають в Субсахарській Африці. Епідемія почалася тут наприкінці 1970-х — на початку 1980-х. Потім епідемія перекинулася в США, Західну Європу та країни Південної Африки. За винятком країн Африки, найшвидше вірус поширюється в Центральній Азії та Східній Європі (зокрема в Росії). Епідемічна ситуація в цих регіонах стримувалася до кінця 1990-х, потім з 1999 по 2002 роки кількість інфікованих майже потроїлася — здебільшого коштом ін'єкційних наркоманів. Значно нижче середня ВІЛ-інфекція поширена в Східній Азії, Північній Африці і на Близькому Сході. У масштабі планети епідемічна ситуація стабілізувалася, кількість нових випадків ВІЛ-інфекції знизилася з 3,5 мільйона 1997 року до 2,7 мільйона 2007 року.
Станом на 2016 рік перше місце у світі за відносною кількістю хворих займав Есватіні, де було інфіковано 27,2% дорослого населення (віком від 15 до 49 років).
Діагностика
Аналіз крові дозволяє виявити антитіла до білків вірусу (ІФА), реакцію антитіл на білки вірусу (вестерн-блот), РНК вірусу (ЗТ-ПЛР). Визначення вірусного навантаження (підрахунок кількості копій РНК вірусу в мілілітрі плазми крові) дозволяє судити про стадію захворювання та ефективність лікування.
Обов'язкова перевірка донорської крові в розвинених країнах значною мірою скоротила можливість передачі вірусу через неї. Тестування на ВІЛ вагітних жінок дозволяє своєчасно розпочати вживання ліків і народити здорову дитину.
Існує думка, що примусове тестування населення безперспективне з погляду стримування епідемії і порушує права людини. У Росії проведення тесту без згоди людини є незаконним, однак існують ситуації, в яких надання результатів тестування на ВІЛ є обов'язковим, але не насильницьким (донорство, працевлаштування медичних працівників, для іноземних громадян, які отримують дозвіл на перебування у РФ, в місцях позбавлення волі за наявності клінічних показань).
Лікування
|
| |
|---|---|
| 1. Наскільки близько ми до звільнення від ВІЛ-інфекції // Канал «Цікава наука» на YouTube, 26 лютого 2020. | |
З-поміж 35 мільйонів осіб, що живуть з ВІЛ-інфекцією, частина залишається в живих завдяки антиретровірусній терапії. За відсутності антиретровірусної терапії ВІЛ-інфекції, смерть настає в середньому через 9-11 років після зараження. Якщо проводити антиретровірусну терапію тривалість життя пацієнта зростає до 70-80 років. Антиретровірусні препарати заважають ВІЛ розмножуватися в клітинах імунної системи людини, блокуючи проходження віріонів у клітини й порушуючи на різних етапах процес збирання нових віріонів. Своєчасно розпочате лікування антиретровірусними препаратами в сотні разів знижує ризик розвитку СНІДу та подальшої смерті. Антиретровірусні препарати у частини пацієнтів спричинюють побічні ефекти, в деяких випадках навіть вимагають змінити схему лікування (набір ліків).
Терапію призначають у разі зниження імунітету та/або високого вірусного навантаження. Якщо кількість CD4+-лімфоцитів велика й вірусне навантаження низьке, терапію не призначають. Після призначення терапії ліки потрібно вживати щодня в один і той же час і довічно, що створює незручності для пацієнтів. Крім того, слід враховувати високу вартість місячного курсу ліків. 2014 року необхідні ліки отримувала менш як половина з 9,5 млн осіб, що потребують противірусної терапії.
Також усі вагітні жінки з ВІЛ-інфекцією повинні починати негайну ВААРТ, щоб запобігти передаванню ВІЛ плоду.
Згідно з рекомендаціями ВООЗ, ВААРТ слід негайно починати всім ВІЛ-інфікованим дітям до півтора року. Початок терапії у дітей, які набули ВІЛ від матері, впродовж 3 місяців після пологів знижує смертність на 75%. За відсутності лікування третина ВІЛ-інфікованих дітей помирає протягом першого року життя і 50% — протягом другого року. Якщо діагностика ВІЛ неможлива, лікування слід починати у віці 9 місяців, або раніше, у разі з'яви симптомів.
Станом на лютий 2016 року було оголошено, що групі німецьких вчених вдалося повністю видалити тип ВІЛ-1 з живих клітин. Випробування проводили на клітинах людини, вживлених піддослідним мишам. Випробування на людях повинні проводити найближчим часом.
2018 року Адміністрація з контролю над продуктами і ліками (FDA) схвалила ібалізумаб (ibalizumab-uiyk) для застосування в терапії пацієнтів із мультирезистентним ВІЛ-1. Препарат являє собою моноклональне антитіло, що зв'язується з CD4 рецепторами T-клітин та пригнічує процес проходження вірусу в клітину людини. Ібалізумаб можна застосовувати в терапії з іншими антиретровірусними препаратами. За результатами клінічних досліджень за участю 40 пацієнтів, які раніше лікувались більш ніж 10 різними антиретровірусними агентами, вірусне навантаження знизилось у більшості випробовуваних через один тиждень після введення першої дози препарату. Через 24 тижні терапії вірусологічної супресії досягнуто в 43 % учасників клінічних випробувань.
ВІЛ 2019 року вносили в список десяти основних проблем охорони здоров'я, які потребують особливої уваги ВООЗ.
Більшість наявних речовин блокують зворотну транскриптазу вірусу.
Попередні експериментальні лікування ВІЛ шляхом пересадки кісткового мозку, який мав властивість рідкісної природної стійкості до вірусу (мутація в CCR5, що протидіє входженню вірусу в Т-лімфоцити) показали, що можна досягти стійкої ремісії. Станом на 2019 рік відомі два пацієнти, так званий «Берлінський пацієнт» Тімоті Рей Браун та «Лондонський пацієнт», у яких було отримано стійку ремісію до ВІЛ.
У 2022 році пацієнтка з США одужала після пересадки стовбурових клітин та стала першою у світі жінкою, яка вилікувалась від ВІЛ. Випадок одужання жінки є частиною дослідження під керівництвом лікаря Івонни Брайсон з Каліфорнійського університету в Лос-Анджелесі (UCLA) та лікаря Дебори Персо з Університету Джона Хопкінса у Балтіморі.
Профілактика
За оцінками, 2,1 мільйона підлітків жили з ВІЛ у 2016 році, переважно з більшості країн Африканського регіону за даними ВООЗ. Хоча загальна кількість смертей, пов'язаних із ВІЛ, зменшується з моменту піку 2006 року, за оцінками, це не стосується підлітків. Це відображає той факт, що більшість сучасних підлітків народилися до того, як профілактика передачі ВІЛ від матері до дитини антиретровірусною терапією набула широкого поширення. Однак значна частина ВІЛ-позитивних підлітків не знає про свій статус, і багато хто з тих, хто знає про свій статус, не отримують ефективного, тривалого антиретровірусного лікування.
Однією з конкретних цілей цілі сталого розвитку в галузі охорони здоров'я (SDG 3) є те, що до 2030 року слід припинити епідемію СНІДу, туберкульозу, малярії та занедбаних тропічних захворювань, гепатитів, захворювань, що передаються водою та інших інфекційних захворювань. Враховуючи високу поширеність ВІЛ у багатьох країнах, для досягнення цієї мети підліткам потрібно буде займати центральне місце для контролю зусиль та сталої профілактики ВІЛ.
Молоді люди повинні знати, як захистити себе від ВІЛ-інфекції та повинні мати засоби для цього:
- можливість отримання презервативів для запобігання передачі вірусу статевим шляхом.
- необхідний кращий доступ до тестування та консультування на ВІЛ та посилення наступних зв'язків із службами лікування ВІЛ для тих, хто отримав ВІЛ-позитивний результат.
Стійкість до ліків
ВІЛ має велику здатність мутувати. Наприклад, відомо більше 20 мутацій (підвидів) протеїну NC (p7). Більшість таких вірусів менш шкідливі (патогенні), ніж вихідний й розмножуються повільніше. З іншого боку, вони можуть мати вищу стійкість проти певного медикаменту. Під час лікування певним препаратом існує етап, коли більшість «старого» типу вірусу загинула, а «мутант» все ще не викорінений. Переривання лікування на цій стадії призводить до резистентності й пацієнт виявляється ураженим формою вірусу стійкою до даного препарату. Найпоширенішою є мутація кількох амінокислот зворотної транскриптази, що приводить до стійкості до одного з перших препаратів-блокаторів зворотної транскрипції вірусу.
Вакцина
У грудні 2021 року група вчених у США заявила про успішне проходження випробувань експериментальної мРНК-вакцини від вірусу імунодефіциту людини (ВІЛ) на мишах та макаках. Вакцини з мРНК містять «набір з інструкціями», який навчає клітини імунної системи виявляти і знищувати клітини вірусів.
Класифікація
Висока мінливість вірусу (0,003 %/на нуклеїнову основу/цикл реплікації) ВІЛ є однією з причин, що сильно ускладнюють розробку антиретровірусних ліків.
Вірус імунодефіциту людини належить до родини ретровірусів (Retroviridae), роду лентивірусів (Lentivirus). Назва Lentivirus походить від латинського слова lente — повільний. Така назва віддзеркалює одну з особливостей вірусів цієї групи, а саме — повільну і неоднакову швидкість розвитку інфекційного процесу в макроорганізмі. Для лентивірусів також характерний тривалий інкубаційний період.
Для вірусу імунодефіциту людини характерна висока частота генетичних змін, що виникають у процесі самовідтворення. Частота виникнення помилок у ВІЛ становить 10−3 — 10−4 помилок на геном на цикл реплікації, що на кілька порядків перевищує аналогічну величину в еукаріотів. Розмір геному ВІЛ становить приблизно 104нуклеотидів. З цього випливає, що практично кожен дочірній геном хоча б на один нуклеотид відрізняється від свого попередника. У сучасній класифікації розрізняють два основні види ВІЛ — ВІЛ-1 і ВІЛ-2. Ці віруси ймовірно виникли внаслідок незалежної передачі людям SIV (вірусу імунодефіциту мавп) шимпанзе і мангабеїв відповідно.
І ВІЛ-1 і ВІЛ-2 здатні викликати серйозний імунодефіцит, однак клінічний перебіг хвороби дещо різниться. Відомо, що ВІЛ-2 менш патогенний і передається з меншою ймовірністю, ніж ВІЛ-1. Ймовірно, це пов'язано з тим, що для інфекції ВІЛ-2 характерне менше число вірусних частинок на мілілітр крові. Відзначено, що інфекція ВІЛ-2 забезпечує носієві деякий незначний захист від зараження ВІЛ-1. Проте описано випадки подвійної інфекції, причому зараження може відбуватися в будь-якому порядку. Інфекція ВІЛ-2 рідше спричиняє розвиток СНІДу. Є відомості про дещо більшу частоту розвитку саркоми Капоші, кандидозу ротової порожнини та хронічної лихоманки при ВІЛ-1/СНІД. При ВІЛ-2/СНІД частіше розвивається енцефаліт, або хронічна бактеріальна діарея, серйозні цитомегаловірусні інфекції і холангіт. До роду Lentivirus також відносять види, що спричиняють схожі захворювання в мавп, кішок, коней, овець і т. д..
ВІЛ-1
ВІЛ-1 описаний 1983 року і є найбільш поширеним і патогенним видом ВІЛ. Глобальна епідемія ВІЛ-інфекції головним чином обумовлена поширенням ВІЛ-1. У переважній більшості випадків, якщо не зазначено інше, під ВІЛ мають на увазі ВІЛ-1.
Вид ВІЛ-1 поділяють на головну групу М і кілька побічних груп. Вважають, що групи M, N, O, P утворилися внаслідок незалежних випадків передачі SIV від мавпи до людини, і подальшої мутації вірусу до ВІЛ.
- Віруси групи М (англ. main — основна) є причиною понад 90 % випадків ВІЛ-інфекції. Групу М поділяють на кілька клад, званих підтипами, що їх також позначають літерами:
- підтип A масово поширений, наприклад, у Західній Африці та Росії;
- підтип B домінує в Європі, Північній Америці, Південній Америці, Японії, Таїланді, Австралії;
- підтип C переважає у Південній і Східній Африці, Індії, Непалі, деяких частинах Китаю;
- підтип D виявлений тільки в Східній і Центральній Африці;
- підтип E не виявлений у нерекомбинантному вигляді, лише спільно з підтипом А як CRF01_AE в Південно-Східній Азії;
- підтип F виявлений у Центральній Африці, Південній Америці та Східній Європі;
- підтип G і рекомбінантна форма CRF02_AG виявлені в Африці і Центральній Європі;
- підтип H виявлений тільки в Центральній Африці;
- підтип I запропоновано для опису штаму-продукту множинної рекомбінації CRF04_cpx декількох підтипів;
- підтип J поширений в Північній, Центральній і Західній Африці і країнах Карибського басейну;
- підтип K виявлений тільки в Конго і Камеруні.
- Група O (англ. outlier — несхожий) виявлена у Центральній Африці і Західній Африці. Найбільш поширена в Камеруні, де 1997 року понад 2 % пацієнтів були заражені вірусом групи (близько 100 000 осіб, за даними на 2013 рік). Віруси цієї групи не визначалися ранніми версіями тест-систем на ВІЛ-1; сучасні тести визначають віруси і групи O, і групи N.
- Група N (англ. non-M, non-O — ні M, ні O) позначає штами не М і не O, описана 1998 року і виявлена тільки в Камеруні. Від 2006 року виявлено лише 10 заражень вірусами групи N.
- Група P — 2009 року визначено нуклеотидну послідовність РНК ВІЛ, значною мірою схожу з вірусом імунодефіциту мавп, описаним у горил (SIVgor), але не із SIV, характерним для шимпанзе (SIVcpz). Вірус виділено зі зразків, отриманих від жінки камерунського походження, що проживає у Франції.
ВІЛ-2
ВІЛ-2 ідентифіковано 1986 року, генетично дуже близький до T-лімфотропного вірусу SIVsmm мангабеїв, і меншою мірою до вірусу ВІЛ-1. Геноми ВІЛ-1 і ВІЛ-2 мають гомологію консервативних генів gag і pol близько 60 %, і до 45 % генів білків оболонки. Станом на 2010 рік описано 8 груп ВІЛ-2, лише групи A і B є епідемічними. Віруси групи А поширені в Західній Африці, Анголі, Мозамбіку, Бразилії, Індії і мало поширені в США і Європі. Віруси групи В поширені в Західній Африці.
Будова віріона

Віріони ВІЛ сферичну форму діаметром приблизно 120 нм. Це приблизно в 60 разів менше за діаметр еритроцита. До складу зрілих віріонів входить кілька тисяч білкових молекул різних типів.
Капсид зрілого віріона, що складається з приблизно 2000 молекул білка р24, має форму зрізаного конуса.
Всередині капсиду розташований білково-нуклеїновий комплекс: дві нитки вірусної РНК, міцно пов'язані з білком нуклеокапсиду p7, ферменти (зворотна транскриптаза, протеаза, інтеграза). З капсидом також асоційовані білки Nef і Vif (7-20 молекул Vif на віріон). Всередині віріона (і, найімовірніше, за межами капсиду) виявлений білок Vpr. Крім того, з капсидом ВІЛ-1 (але не ВІЛ-2) пов'язані близько 200 копій клітинного ферменту пептидилпролілізомерази A[en] (циклофілін А), необхідного для складання віріона.
Капсид оточений оболонкою, утвореною з приблизно 2000 молекул матриксного білка p17. Матриксна оболонка, в свою чергу, оточена двошаровою ліпідною мембраною, що є зовнішньою оболонкою вірусу. Її утворюють молекули фосфоліпідів, захоплені вірусом під час його відбрунькування від клітини, в якій він сформувався. В ліпідну мембрану вбудовані 72 глікопротеїнові комплекси Env, кожен з яких утворений трьома молекулами трансмембранного глікопротеїну gp41 (TM), що слугує «якорем» комплексу, і трьома молекулами поверхневого глікопротеїну gp120 (SU). З допомогою білка gp120 вірус приєднується до рецептора CD4 і корецептора, що розташовані на поверхні Т-лімфоцитів людини. Стехіометричне співвідношення p24:gp120 у віріона становить 60-100:1. Під час формування зовнішньої оболонки вірусу також відбувається захоплення деякої кількості мембранних білків клітини, зокрема людських лейкоцитарних антигенів (HLA) класів I і II і молекул адгезії.
Білки віріона інтенсивно вивчають, оскільки вони є мішенями розроблюваних ліків і вакцини проти ВІЛ.
Функції важливих структурних білків ВІЛ-1
| Скорочення | Опис | Функції |
|---|---|---|
| gp41 (TM, transmembrane) | Трансмембранний глікопротеїн масою 41 кДа | Розташований у зовнішньому шарі ліпідної мембрани, відіграє роль «якоря», що утримує молекули білка gp120 |
| gp120 (SU, surface) | Глікопротеїн масою 120 кДа | Зовнішній білок віріона. Нековалентно пов'язаний з трансмембранним білком gp41. З однією молекулою gp41 пов'язані 3-5 молекул gp120. Здатний зв'язувати рецептор CD4. Відіграє важливу роль у процесі проходження вірусу в клітину. |
| p24 (CA, capsid) | Білок масою 24 кДа | Утворює капсид вірусу |
| p17 (MA, matrix) | Матриксний білок масою 17 кДа | Близько двох тисяч молекул цього білка утворюють шар завтовшки 5-7 нм, розташований між зовнішньою оболонкою і капсидом вірусу. |
| p7 (NC, nucleocapsid) | Нуклеокапсидний білок масою 7 кДа | Входить до складу капсиду вірусу. Утворює комплекс з вірусної РНК. |
Геном і кодовані білки
Генетичний матеріал ВІЛ представлений двома копіями позитивно-смислової (+)РНК. Геном ВІЛ-1 завдовжки 9000 нуклеотидів. Кінці геному представлені довгими кінцевими повторами (англ. long terminal repeat, LTR), які керують продукуванням нових вірусів і можуть активуватися і білками вірусу, і білками інфікованої клітини.
9 генів ВІЛ-1 кодують, принаймні, 15 білків. Ген pol кодує ферменти: зворотну транскриптазу (RT), інтегразу (IN) і протеазу (PR). Ген gag кодує поліпротеїн Gag/p55, що його вірусна протеаза розщеплює до структурних білків p6, p7, p17, p24. Ген env кодує білок gp160, що його клітинна ендопротеаза фурин розщеплює на структурні білки gp41 і gp120. Інші шість генів — tat, rev, nef, vif, vpr, vpu (vpx у ВІЛ-2) — кодують білки, що відповідають за здатність ВІЛ-1 інфікувати клітини і виробляти нові копії вірусу. Реплікація ВІЛ-1 in vitro можлива без генів nef, vif, vpr, vpu, однак їх продукти необхідні для повноцінної інфекції in vivo.
Gag
Поліпротеін-попередник Gag/p55 синтезується з повнорозмірною геномною РНК (яка в цьому разі слугує мРНК) у процесі стандартної кеп-залежної трансляції, але можлива й IRES-залежна трансляція. Попередники функціональних білків розташовуються у складі поліпротеїну Gag/p55 в такому порядку: p17…p24…p2…p7…p1…p6 (р1 і р2 — з'єднувальні пептиди; інші продукти розщеплення Gag/p55 описано вище). Нерозщеплений протеазою Gag/p55 містить три основні домени: домен мембранної локалізації (М, membrane targeting), домен взаємодії (I, interaction) і «пізній» домен (L, late). Домен М, розташований всередині області p17/МА, міристилюється (приєднуються залишки міристинової кислоти) і направляє Gag/p55 до плазматичної мембрани. Домен I, що розташований всередині області p7NC (NC, nucleocapsid), відповідає за міжмолекулярні взаємодії окремих мономерів Gag/p55. Домен L, також локалізований в області p7NC, опосередковує відбрунькування віріонів від плазматичної мембрани; в цьому процесі бере участь також р6 область поліпротеїну Gag/p55.
Vpu
Двома важливими функціями білка Vpu є: 1) руйнування клітинного рецептора CD4 в ендоплазматичному ретикулумі шляхом залучення убіквітинлігазних комплексів і 2) стимуляція виділення дочірніх віріонів з клітини шляхом інактивації інтерферон-індукованого трансмембранного білка CD317/BST-2, що дістав також назву «tetherin» за його здатність пригнічувати виділення новоутворених дочірніх віріонів, утримуючи їх на поверхні клітини.
Vpr
Білок Vpr потрібний для реплікації вірусу в неподільних клітинах, зокрема, макрофагах. Цей білок, поряд з іншими клітинними та вірусними білками, активує транскрипцію з використанням довгих кінцевих повторів геному ВІЛ як промоторів. Білок Vpr відіграє важливу роль у перенесенні вірусної ДНК в ядро і викликає затримку поділу клітини в періоді G2.
Vif
Білок Vif відіграє важливу роль у підтримці реплікації вірусу. Vif індукує убіквітинілювання і деградацію клітинного антивірусного білка APOBEC3G, який викликає деамінування ДНК, що призводить до мутаційних замін G на A у вірусній ДНК, синтезованій у процесі зворотної транскрипції. Штами, позбавлені Vif, не реплікуються в CD4+-лімфоцитах, деяких лініях T-лімфоцитів і макрофагах. Ці штами здатні проникати в клітини-мішені й починати зворотну транскрипцію, проте синтез вірусної ДНК залишається незавершеним.
Nef
Білок Nef виконує кілька функцій. Він пригнічує експресію молекул CD4 і HLA класів I і II на поверхні інфікованих клітин, чим дозволяє вірусу уникати атаки цитотоксичних T-лімфоцитів і розпізнавання CD4+-лімфоцитами. Білок Nef може також пригнічувати активацію T-лімфоцитів, пов'язуючи різні білки-компоненти систем внутрішньоклітинного передавання сигналу.
В інфікованих вірусом імунодефіциту макак-резусів активна реплікація вірусу і розвиток хвороби можливі лише коли ген nef інтактний. Делеції гена nef виявлено в штамах ВІЛ, виділених у групи австралійців з тривалим непрогресивним перебігом інфекції. Однак у частини з них з часом з'явилися ознаки прогресування інфекції, зокрема, знизилась кількість CD4+-лімфоцитів. Отже, хоча делеції гена nef і можуть сповільнювати реплікацію вірусу, це не гарантує повної неможливості прогресування захворювання.
Tat і Rev
Регуляторні білки Tat (транс-активатор) і Rev накопичуються в ядрі клітини і пов'язують певні ділянки вірусної РНК. Білок Tat має молекулярну масу близько 14-15 кДа, пов'язує вторинну структуру геномної РНК поблизу 5'-нетрансльованої області, активує зворотну транскрипцію геномної РНК ВІЛ, синтез вірусних мРНК, необхідний для реплікації вірусу майже у всіх культурах клітин, регулює вихід віріонів із заражених клітин, потребує клітинного кофактора — цикліну T1. Білок Rev регулює експресію білків віріона, пов'язує мРНК гена env в області RRE (англ. Rev response element) інтрона, що розділяє екзони генів Tat і Rev.
Білки Tat і Rev стимулюють транскрипцію провірусної ДНК і транспорт РНК з ядра в цитоплазму, а також потрібні для трансляції. Білок Rev забезпечує також транспорт компонентів вірусу з ядра і переключення синтезу регуляторних білків вірусу на синтез структурних.
Життєвий цикл вірусу

Після потрапляння в організм людини ВІЛ проникає в клітини-мішені — Т-лімфоцити (CD4), які виконують регуляторну роль в імунній відповіді. Крім цього, ВІЛ здатний проникати в інші клітини, що обумовлює залучення в патологічний процес різних органів і систем. Геном ВІЛ, включений до геному клітини-господаря, носить назву «провірусу». ВІЛ має високу активність, продукуючи 1010 вірусних часток щодня. Якщо пацієнт отримує недостатньо ефективну антиретровірусну терапію формуються варіанти вірусу, стійкі до препаратів. При «природному перебігу» ВІЛ інфекції виявляється висока швидкість утворення і руйнування лімфоцитів — 109 клітин в день. У цій «гонці на виживання» вірус з часом перемагає, вражаючи клітини імунної системи. Їх загибель призводить до формування імунодефіциту, який проявляється розвитком симптомів, пов'язаних як з ВІЛ-інфекцією, так і з вторинними захворюваннями інфекційного та неінфекційного ґенезу.
До проникнення в клітину-мішень
Потрапивши на поверхню та всередину організму, віріони ВІЛ опиняються в різних за агресивністю біологічних рідинах. Слина та шлунковий сік містять ферменти, що більшою мірою руйнують віріони ВІЛ, ніж інші біологічні рідини (це не стосується немовлят перших місяців життя, у яких ще не виробляються відповідні ферменти травлення, тому немовлята можуть заразитись через грудне молоко). Віріони ВІЛ проходять у кровоносну і лімфатичну систему організму і переміщуються по організму в потоці крові і лімфи. Опинившись поруч з CD4-клітиною, віріони ВІЛ приєднуються до рецептора CD4 на її плазматичній мембрані.
Проходження в клітину і зворотна транскрипція
|
Механізм злиття віріона ВІЛ і плазматичної мембрани Т-лімфоцита людини 
2. Конформаційні зміни вірусного білка gp120 забезпечують зв'язування з клітинним рецептором CCR5 (зазначено червоною стрілкою)

3. Кінцеві ділянки вірусного білка gp41 проходять у плазматичну мембрану клітини (зазначено червоною стрілкою)

4. Вірусний білок gp41 зазнає значних конформаційних змін (зазначено червоною стрілкою), що призводить до зближення і злиття мембран віріона і клітини
|
Вірусний глікопротеїн gp120 міцно пов'язує рецептор CD4. Внаслідок такої взаємодії gp120 зазнає конформаційних зміни, які дозволяють йому зв'язувати молекулу корецептора CXCR4 або CCR5 (експресованих на поверхні Т-лімфоцитів, макрофагів, дендритних клітин мікроглії). Залежно від здатності зв'язувати ці корецептори, ВІЛ класифікують на R5-тропні (пов'язують тільки корецептор CCR5), X4-тропні (пов'язують тільки корецептор CXCR4) і R5X4-тропні (можуть взаємодіяти з обома корецепторами) варіанти. При зараженні здебільшого передаються R5-тропні і R5X4-тропні варіанти. Препарати, що блокують корецептори, можуть протидіяти ВІЛ.
Після описаних подій вірусний білок gp41 проходить у мембрану клітини і зазнає значних конформаційних змін, внаслідок яких мембрана клітини і мембрана віріона ВІЛ зближуються одна з одною й потім зливаються. Вірусний білок gp41 дуже важливий для злиття мембран, тому його розглядають як мішень для розробки противірусних препаратів.
Після злиття мембран вміст віріона проходить всередину клітини. Всередині клітини вірусна РНК вивільняється з капсиду. Потім під дією зворотної транскриптази відбувається зворотна транскрипція — процес синтезу ДНК на підставі інформації в одноланцюговій геномній РНК вірусу. Більша частина лікарських препаратів, затверджених для застосування при ВІЛ-інфекції, спрямована на порушення роботи зворотної транскриптази.
Транспорт вірусної ДНК в ядро та інтеграція в геном
Після завершення зворотної транскрипції в CD4+-лімфоциті вірусний геном представлений невбудованою ДНК. Для вбудування вірусної ДНК в геном клітини-господаря і для утворення нових вірусів потрібна активація T-лімфоцитів. Активація CD4+-лімфоцитів відбувається коли вони контактують з антигенпредставленими клітинами в лімфоїдній тканині. Наявність вірусів на поверхні фолікулярних дендритних клітин і присутність прозапальних цитокінів (ІЛ-1, ІЛ-6 і ФНОа) сприяють розмноженню ВІЛ в інфікованих клітинах. Саме тому лімфоїдна тканина є найсприятливішим середовищем для реплікації ВІЛ.
Синтезована вірусна ДНК транспортується всередину ядра клітини в складі пре-інтеграційного комплексу, до якого також належать білки ВІЛ p17/MA, Nef та інтеграза. Далі вірусна ДНК вбудовується в хромосому активованого T-лімфоцита під дією інтегрази. Кілька препаратів, що інгібують інтегрази, широко застосовують у сучасній комплексній антиретровірусній терапії. Вірусна ДНК, що вбудувалась у хромосому клітини, називається провірусом.
Транскрипція, сплайсинг, транспорт РНК з ядра в цитоплазму і трансляція
В ядрі клітинна РНК-полімераза синтезує попередник вірусних інформаційних РНК (мРНК), довжина якого дорівнює довжині геномної РНК ВІЛ-1. Цей попередник мРНК піддається 5'-кінцевому кепуванню і 3'-кінцевому поліаденілюванню. Крім того, попередник мРНК піддається сплайсингу, внаслідок якого утворюються понад 40 різних мРНК, що їх можна поділити на 3 класи:
- несплайсована РНК завдовжки близько 9.3 kb — далі використовується як мРНК для синтезу білків Gag і Gag-Pol, а також як геномна РНК;
- неповністю сплайсовані РНК завбільшки близько 4 kb — використовуються як мРНК для синтезу білків Vif, Vpr, Tat, Vpu і Env;
- повністю сплайсовані РНК завбільшки близько 2 kb — використовуються як мРНК для синтезу білків Vpr, Tat, Rev і Nef.
На ранній стадії експресії генів, за відсутність білка Rev, несплайсована і неповністю сплайсовані РНК ВІЛ-1 нестабільні й швидко руйнуються в ядрі. Водночас повністю сплайсовані мРНК ВІЛ-1 є стабільними і транспортуються з ядра в цитоплазму. В цитоплазмі за допомогою рибосом відбувається процес трансляції — біосинтез білка з амінокислот за заданою матрицею на основі генетичної інформації, що міститься в мРНК. Синтезований в цитоплазмі білок Rev транспортується в ядро, де зв'язується з областю RRE несплайсованої й неповністю сплайсованих РНК, що стабілізує ці РНК. Крім того, Rev взаємодіє з клітинним білком CRM1 (експортин 1), і ця взаємодія стимулює транспорт несплайсованої й неповністю сплайсованих РНК з ядра в цитоплазму, де відбувається синтез закодованих у них білків.
Збирання й відбрунькування віріонів
Геномна РНК вірусу, а також вірусні білки транспортуються до місць збирання віріонів — до мембрани. Віріони спочатку формуються з поліпротеїнів-попередників структурних білків і ферментів і на цій стадії не є інфекційними. Під час дозрівання вірусної частинки вірусна протеаза розщеплює білки-попередники до функціональних компонентів. Кілька схвалених противірусних препаратів інгібують роботу протеази і перешкоджають формуванню зрілих віріонів.
Нові вірусні частинки відбруньковуються від поверхні клітини, захоплюючи частину її мембрани, і виходять у кров'яне русло, а клітина хазяїна, що несе рецептор CD4, гине. Нещодавні дослідження показали, що процес відбруньковування віріонів може бути більш складним, ніж вважали раніше. Так було виявлено, що завдяки взаємодії білка Gag з компонентами клітини віріони накопичуються в особливих внутрішньоклітинних мультивезикулярних тільцях, які зазвичай слугують для експорту білків. Таким чином вірусні частинки вивільняються з клітини, експлуатуючи її власну систему транспорту макромолекул.
Поширення організмом
Віріон ВІЛ, що тільки-но виділився з зараженого лімфоцита у плазмі крові живе в середньому близько 8 годин. Тривалість напівжиття (час, за який гине 50 % віріонів ВІЛ) у плазмі крові становить приблизно 6 годин. В інших середовищах тривалість напівжиття віріонів ВІЛ на порядки менше.
Під час гострої фази ВІЛ-інфекції відсутність специфічної імунної відповіді дозволяє вірусу активно реплікуватися й досягати високих концентрацій у крові. Вірус заселяє органи лімфатичної системи, CD4+-лімфоцити, макрофаги, а також інші клітини: альвеолярні макрофаги легень, клітини Лангерганса, фолікулярні дендритні клітини лімфатичних вузлів, клітини олігодендроглії й астроцити мозку і епітеліальні клітини кишки. У лімфоїдній тканині ВІЛ розмножується протягом усього захворювання, вражаючи макрофаги, активовані і спокійні CD4+-лімфоцити і фолікулярні дендритні клітини. Кількість клітин, що містять провірусну ДНК, у лімфоїдній тканині в 5-10 разів вища, ніж серед клітин крові, а реплікація ВІЛ в лімфоїдній тканині на 1-2 порядки вища, ніж у крові. Основним клітинним резервуаром ВІЛ є CD4+-Т-лімфоцити імунологічної пам'яті.
Для активації CD8+-лімфоцитів і утворення антиген-специфічних цитотоксичних T-лімфоцитів потрібна презентація пептидного антигену в комплексі з людським лейкоцитарним антигеном класу I. Дендритні клітини, потрібні для початку первинних антиген-специфічних реакцій, захоплюють антигени, переробляють і переносять їх на свою поверхню, де ці антигени в комплексі з додатковими стимулювальними молекулами активують Т-лімфоцити. Заражені клітини часто не виділяють додаткових стимулювальних молекул і тому не здатні викликати активацію достатньої кількості B-лімфоцитів і T-лімфоцитів, функція яких залежить від дендритних клітин.
На 2018 рік ВІЛ-інфекція досі залишається невиліковним захворюванням, оскільки геном вірусу інтегрується в хромосоми клітин і може реактивуватися навіть після курсу антиретровірусної терапії. Нині йде пошук безпечних способів редагування геному людини та виключення з нього провірусної ДНК. 2014 року запропоновано метод видалення геному ВІЛ-1 інфікованих клітин за допомогою системи CRISPR/Cas9. За допомогою цього методу дослідникам вдалося вирізати фрагмент провірусної ДНК, розташований між 5'- і 3'-кінцевими LTR-областями з хромосом заражених клітин у культурі. Крім того, цей метод виявився також ефективним для профілактики зараження неінфікованих клітин. Описаний підхід може привести до розробки способу повного позбавлення від ВІЛ-інфекції.
Природна стійкість до ВІЛ
Описано випадки стійкості людей до ВІЛ. Проникнення вірусу в клітину імунної системи пов'язане з його взаємодією з поверхневим рецептором, білком CCR5. Делеція (втрата ділянки гена) CCR5-дельта32 призводить до несприйнятливості її носія до ВІЛ. Передбачають, що ця мутація виникла приблизно дві з половиною тисячі років тому і з часом поширилася в Європі. Нині до ВІЛ фактично стійкий в середньому один відсоток жителів Європи, 10-15 % європейців мають часткову опірність до ВІЛ. 0,1–0,3 % російського населення майже несприйнятливі до ВІЛ. Вчені Ліверпульського університету пояснюють поширення мутації гена CCR5 тим, що вона посилює опірність до бубонної чуми. Епідемія «чорної смерті» 1347 року (а в Скандинавії ще й 1711 року) сприяла збільшенню частоти цього генотипу в Європі.
Мутація в гені CCR2 також зменшує шанс проникнення ВІЛ у клітину і призводить до затримки розвитку СНІДу. Існує невеликий відсоток ВІЛ-позитивних людей (близько 10 %), у яких СНІД не розвивається протягом тривалого часу. Їх називають нонпрогресорами (nonprogressors).
Важливий клітинний компонент захисту проти ВІЛ — антивірусний білок APOBEC3G, який викликає деамінування ДНК, що призводить до мутаційних замін G на A у вірусній ДНК, яка синтезується під час зворотної транскрипції. APOBEC3G інактивується білком Vif ВІЛ-1, який викликає його убіквітинілювання і деградацію.
Виявлено, що одним з головних елементів антивірусного захисту людини та інших приматів є білок TRIM5a, здатний розпізнавати капсид вірусних частинок і перешкоджати розмноженню вірусу в клітині. TRIM5a людини і шимпанзе дещо різняться й ефективні проти різних вірусів: цей білок захищає шимпанзе від ВІЛ та споріднених йому вірусів, а людину — від вірусу PtERV1. Мавпи Нового Світу, за винятком мірікіни, яка має химерний ген TRIM5-CypA, стійкості до ВІЛ не мають.
Інший важливий елемент антивірусного захисту — інтерферон-індукований трансмембранний білок CD317/BST-2 (англ. bone marrow stromal antigen 2). CD317 — трансмембранний білок 2-го типу з незвичайною топологією: він має трансмембранний домен поруч з N-кінцем і глікозилфосфатидилінозитол (GPI) на С-кінці, між якими розташований позаклітинний домен. Показано, що CD317 безпосередньо взаємодіє зі зрілими дочірніми віріонами, «прив'язуючи» їх до поверхні клітини. Для пояснення механізму такого «прив'язування» запропоновано кілька альтернативних моделей, які, проте, сходяться в наступному: молекули CD317 формують паралельний гомодимер; один або два гомодимери зв'язуються одночасно з одним віріоном і клітинною мембраною. При цьому з мембраною віріона взаємодіють або обидва мембранні «якорі» (трансмембранний домен і GPI) однієї з молекул CD317, або один з них. Спектр активності CD317 включає, принаймні, чотири сімейства вірусів: ретровіруси, філовіруси, аренавіруси і герпесвіруси. Активність цього клітинного фактора інгібується білками Vpu ВІЛ-1, Env ВІЛ-2 і SIV, Nef SIV, глікопротеїном оболонки вірусу Ебола і білком К5 герпесвірусу саркоми Капоші. Виявлено кофактор білка CD317 — клітинний білок ВСА2 (Breast cancer-associated gene 2; Rabring7, ZNF364, RNF115) — Е3-убіквітинлігаза класу RING. BCA2 посилює інтерналізацію віріонів ВІЛ-1, «прив'язаних» білком CD317 до поверхні клітини, в CD63+ внутрішньоклітинні везикули з їхнім подальшим руйнуванням у лізосомах.
Редагування геному людини
У січні 2019 року влада Китаю підтвердила народження в Шеньчжені перших у світі генетично модифікованих людей, у яких відредагували ген CCR5, відповідальний за взаємодію з ВІЛ, а також почала розслідування щодо біолога Хе Цзянькуя. Передбачають, що генномодифіковані діти не можуть захворіти на ВІЛ.
Міфи
Існує ненаукова думка, що ВІЛ не існує або не призводить до СНІДу. Її дотримуються навіть деякі вчені, не залучені у вивчення вірусів. Наявності таких уявлень сприяє довга фаза між зараженням ВІЛ та розвитком СНІДу й те, що в деяких уражених ВІЛ СНІД взагалі не розвивається. Проте факт наявності ВІЛ у хворих на СНІД на сьогодні незаперечний.
Так само блукає міф про штучне походження ВІЛ, правда, не витримуючи жодної критики, оскільки є достеменно відома історія вірусу, який існує більше 200 років, коли його створити штучно не було можливо.
Див. також
- ВІЛ-інфекція в Україні
- ВІЛ серед ЧСЧ та транс-людей в Україні
- Жінки, які практикують секс із жінками
- Тімоті Рей Браун («Берлінський пацієнт») — перша людина, яка вилікувалась від ВІЛ/СНІДу.
- Роберт Рейфорд («пацієнт зіро») — перша зареєстрована жертва ВІЛ/СНІДу в Північній Америці.
- Арвід Ное — перша зареєстрована жертва ВІЛ/СНІДу в Європі.
- Грете Раск — одна з перших жертв ВІЛ/СНІДу в Європі.
- Гаетан Дюга — канадський бортпровідник, що зробив значний внесок у поширення вірусу в Північній Америці. Раніше його помилково ідентифікували як «нульового пацієнта».
Література
- Туберкульоз, ВІЛ-інфекція/СНІД. Затверджено Міністерством освіти і науки України як навчальний посібник для студентів вищих навчальних закладів. Рекомендовано Міністеством охорони здоров'я України як навчальний посібник для студентів вищих медичних навчальних закладів III—IV рівнів акредитації / За редакцією члена-кореспондента, професора В. Ф. Москаленка, професора Р. Г. Процюка. — Київ : «Медицина», 2009. — 424 с. — ISBN 978-966-10-0059-8.
- Bushman F.D., Nabel G.J., Swanstrom R. (Editors). HIV: From biology to prevention and treatment. — Cold Spring Harbor, New York, USA : Cold Spring Harbor Laboratory Press, 2012. — 572 с. — ISBN 978-193611340-8.
- Levy J.A. HIV and the pathogenesis of AIDS. — Third edition. — ASM Press, 2007. — 644 с. — ISBN 978-1-55581-393-2.
- Pancino G., Silvestri G., Fowke K. (Editors). Models of protection against HIV/SIV: Avoiding AIDS in humans and monkeys. — UK-USA-Canada : Academic Press, 2012. — 345 с. — ISBN 978-0-12-387715-4.
- Pepin J. The origins of AIDS. — New York, USA : Cambridge University Press, 2011. — 293 с. — ISBN 978-0-52118637-7.
- Prasad V.R., Kalpana G.V. (Editors). HIV protocols. — Humana Press, 2009. — 457 с. — ISBN 978-1-58829-859-1.
- Sax P.E., Cohen C.J., Kuritzkes D.R. (Editors). HIV essentials. — Jones and Bartlett Learning, 2012. — 248 с. — ISBN 978-1-4496-5092-6.
- Spearman P., Freed E.O. (Editors). HIV interactions with host cell proteins. — Springer, 2009. — 204 с. — ISBN 978-3-642-02174-9.
- Weeks B.B., Alcamo I.E. AIDS: The biological basis. — USA - Canada - UK : Jones and Bartlett Publishers, 2010. — 360 с. — ISBN 978-0-7637-6324-4.
Посилання
- Безкоштовно дізнатися свій ВІЛ статус. [Архівовано 23 лютого 2020 у Wayback Machine.]
- Найбезглуздіші легенди про ВІЛ, в які соромно вірити [Архівовано 8 листопада 2018 у Wayback Machine.]
- Популярно про ВІЛ-інфекцію [Архівовано 2 грудня 2012 у Wayback Machine.]
- Питання діагностики та терапії ВІЛ-інфекції/СНІД [Архівовано 3 лютого 2015 у Wayback Machine.]
- Історія та етіологія ВІЛ-інфекції [Архівовано 3 лютого 2015 у Wayback Machine.]
- Доктор Панацейко та його поради [Архівовано 1 листопада 2008 у Wayback Machine.], анімаційний проект фонду Олени Франчук «АнтиСНІД»
| ||||||||||||||||||||||||||||||||
|
|