
Карбонат магнію
| Карбонат магнію | |
|---|---|
| |

| |
| Назва за IUPAC | магній карбонат |
| Інші назви | магній вуглекислий |
| Ідентифікатори | |
| Номер CAS | 546-93-0 |
| Номер EINECS | 208-915-9 |
| DrugBank | 09481 |
| KEGG | C12893 |
| ChEBI | 31793 |
| RTECS | OM2470000 |
| Код ATC | A02AA01 і A06AD01 |
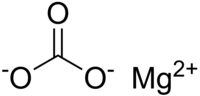
| SMILES | C(=O)([O-])[O-].[Mg+2] |
| InChI | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
| Властивості | |
| Молекулярна формула | MgCO3 |
| Молярна маса | 84,314 г/моль |
| Зовнішній вигляд | білі кристали |
| Густина | 3,05 г/см³ |
| Тпл | розкл. при 350 °C |
| Розчинність (вода) | 0,18 г / 100 г (20 °C) |
| Розчинність (етанол) | нерозчинний |
| Показник заломлення (nD) | 1,717 |
| Структура | |
| Кристалічна структура | гексагональна |
| Термохімія | |
|
Ст. ентальпія утворення ΔfH 298 |
-1095,8 кДж/моль |
|
Ст. ентропія S 298 |
65,7 Дж/(моль·K) |
|
Теплоємність, c p |
75,51 Дж/(моль·K) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Карбона́т ма́гнію, ма́гній карбона́т — неорганічна сполука складу MgCO3. За звичайних умов є білими кристалами, що мають діамагнітні властивості.
У холодній воді він не розчиняється (ДР=6,82⋅10-6), а в гарячій переходить у гідроксокарбонат Mg2(OH)2CO3.
Застосовується у виготовленні вогнетривких матеріалів, пігментів. Використовується як харчовий додаток (E504).
Зміст
Поширення у природі
У земній корі карбонат магнію може перебувати у вільному стані, у формі кристалогідратів, а також у складі осно́вних і подвійних солей.
Чистому карбонату магнію відповідає мінерал магнезит. До кристалогідратів відносяться: баррингтоніт MgCO3·2H2O, несквегоніт MgCO3·3H2O і лансфордит MgCO3·5H2O.
До мінералів з осно́вним складом (суміш карбонату і гідроксиду магнію) належать: артиніт MgCO3·Mg(OH)2·3H2O, гідромагнезит 4MgCO3·Mg(OH)2·4H2O, дипінгіт 4MgCO3·Mg(OH)2·5H2O, йошикаваїт 4MgCO3·Mg(OH)2·8H2O.
Серед подвійних солей значне поширення має доломіт CaCO3·MgCO3 — разом з магнезитом він відноситься до основних джерел для отримання карбонату магнію, а також чистого магнію. До інших розповсюджених мінералів належать такі, що містять:
- спільний іон магнію: брейннерит (Mg,Fe)CO3, MgCO3·MgCl2·7H2O, MgCO3·MgBr2·7H2O, MgCO3·MgBr2·8H2O;
- спільний карбонат-іон: MgCO3·Na2CO3, MgCO3·K2CO3·8H2O, MgCO3·KHCO3·4H2O, MgCO3·NH4CO3·4H2O, MgCO3·Na2CO3.
Отримання
Основним способом добування карбонату магнію є переробка мінеральної сировини.
До застосовуваних синтетичних способів належить, зокрема, обробка суспензії гідроксиду магнію вуглекислим газом під тиском 3,5—5 атм і за температури нижче 50 °C, внаслідок чого утворюється гідрокарбонат магнію, який потім прокалюють у струмені сухого повітря при 130 °C:
Також застосовується метод, що полягає у взаємодії карбонатів з іншими солями магнію:
Такі реакції проводять в умовах високого тиску вуглекислого газу, оскільки безводний MgCO3 в інший спосіб виділити не вдається.
Хімічні властивості
При нагріванні понад 350 °C карбонат магнію розкладається на оксид магнію і CO2
У воді він не розчинний, однак при дії вуглекислого газу може утворювати розчинний гідрокарбонат, який зумовлює наявність тимчасової твердості води та руйнується при кипінні:
У гарячій воді він також може утворювати гідроксокарбонат, який із часом, у присутності вуглекислого газу, розкладається до вихідного карбонату:
Як й інші карбонати, MgCO3 є нестійким до дії кислот:
Застосування
Карбонат магнію застосовують у виготовленні вогнетривкої цегли, футеровки металургійних печей, цементу. Він є пігментом у фарбах, кераміці. Його добавки у пластик збільшують вогнестійкість матеріалу і зменшують димоутворення. Високочистий карбонат у медицині є препаратом антацидної дії.
У харчовій промисловості карбонат магнію відіграє роль фіксатора забарвлення, регулятора кислотності, антиспікаючого агента. У переліку харчових додатків він має код E504.
Див. також
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Patnaik, P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8. (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Seeger, M., Otto, W., Flick, W., Bickelhaupt, F., Akkerman, Otto S. Magnesium Compounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 15. — P. 341—343. — ISBN 978-0-471-48517-9. — DOI:10.1002/14356007.a15_595. (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / Под ред. В. И. Спицына. — М. : Мир, 1971. — Т. 1. — С. 187. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
Посилання
- МАГНІЮ КАРБОНАТ [Архівовано 14 квітня 2016 у Wayback Machine.] //Фармацевтична енциклопедія










