
Нафтален
| Нафтален | |
|---|---|
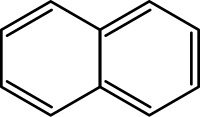
| |

| |
| Назва за IUPAC | біцикло[4.4.0]дека-1,3,5,7,9-пентен |
| Інші назви | нафталін, камфорна смола, біла смола, albocarbon, antimite, moth flakes |
| Ідентифікатори | |
| Номер CAS | [1] 91-20-3 |
| PubChem | [1] 931 |
| Номер EINECS | 202-049-5 |
| KEGG | C00829 |
| ChEBI | 16482 |
| RTECS | QJ0525000 |
| SMILES | c1ccc2ccccc2c1 |
| InChI | 1/C10H8/c1-2-6-10-8-4-3-7-9(10)5-1/h1-8H |
| Номер Бельштейна | 1421310 |
| Номер Гмеліна | 3347 |
| Властивості | |
| Молекулярна формула | C10H8 |
| Молярна маса | 128,17 г/моль |
| Зовнішній вигляд | Білі кристали або пластівці, характерний різкий запах |
| Густина | 1,15 г/см³ |
| Тпл | 80.26 |
| Ткип | 218 |
| Розчинність (вода) | 31 мг/л |
| Небезпеки | |
| ЛД50 | 533 мг/кг (миші, орально) |
| ГГС піктограми |

|
| ГГС формулювання небезпек | H228, H302, H351, H410 |
| ГГС запобіжних заходів |
P201, P202, P264, P270, P273, P281, P301+P312, P308+P313
, P330, P391, P405, P501 |
| R-фрази | R22, R40, R50/53 |
| S-фрази | S2, S36/37/39, S45, Шаблон:S46, S60, S61 |
| Головні небезпеки | легкозаймистий, чутливий до удару, можливий канцероген. Пил може утворювати вибухонебезпечні суміші з повітрям |
| NFPA 704 | |
| Температура спалаху | 80 °C |
| Температура самозаймання | 540 °C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Нафталéн, також нафталíн — найпростіший представник вуглеводнів з конденсованими ароматичними кільцями.
Зміст
Історія
Був відкритий у кам’яновугільній смолі А. Гарденом в 1819 р. Елементний склад його встановив О. А. Воскресенський у 1838 році, структурну формулу запропонував Е. Ерленмейєр у 1866 році, а К. Гребе підтвердив її хімічним шляхом у 1868 році.
Фізичні властивості
Біла кристалічна речовина, дуже летка та легко сублімується.
Отримання
Нафтален отримують з кам'яновугільної смоли, його вміст у фракції 210-230°C досягає 40%.
Продукти риформінгу нафти містять багато метилнафталену. З нього нафтален можна отримати при гідродеметилюванні: приєднанні водню, коли один атом приєднується до метильної групи, утворюючи метан, а інший — до нафталенового ядра з утворенням нафталену. Реакцію проводять при температурі 750°С у присутності каталізаторів — кобальту або молібдену.
Нафтален також утворюється при конденсації бензену та ацетилену:

Ще один спосіб отримання — дієновий синтез. При взаємодії 1,4-бензохінону з бутадієном утворюється тетрагідронафтохінон. Спочатку його дегідрують (утворюється 1,4-нафтохінон), а далі відновлюють воднем у присутності платини.
Хімічні властивості
Будова молекули
Молекула нафталіну складається з двух конденсованих бензольних кілець. Атоми карбону у молекулі нафталену нумеруются наступним чином:
Атоми карбону, які не зв'язані з атомами гідрогену, не нумеруються, тому що до них не може приєднатися замісник.
Будова нафталену виражається резонансними структурами:
З резонансних структур видно, що не всі зв'язки є рівними. Наприклад, у двох з трьох резонансних структур зв'язок С2-С3 є одинарним, а в одній - подвійним. А зв'язок С1-С2 у двох структурах подвійний, а в одній - одинарний, тому він є більш ненасиченим за С2-С3.
Це підтверджується довжинами зв'язків: відомо, що довжина зв'язку С1-С2 дорівнює 135,6 пм, а зв'язку C2-C3 - 142,5 пм, а чим коротший зв'язок, тим більша його ненасиченість.
Усе це свідчить про те, що нафтален є менш ароматичним, ніж бензен, деякі зв'язки є більш ненасиченими. Через це нафтален легше вступає у реакції приєднання.
Реакції
Нафталіну найбільш притаманні реакції електрофільного заміщення.
Електрофільне заміщення
Переважно заміщується в α-положення (1,4,5,8 атоми карбону), оскільки так при делокалізації позитивного заряду, який утворюється при приєднанні електрофіла до ненасиченого зв'язку, ароматична структура іншого кільця не порушується. Також, у α-положеннях є надлишок електронної густини, тобто вони є нуклеофільними. При β-заміщенні позитивний заряд може переходити до іншого ядра, і його структура перетвориться на хіноїдну.
Галогенування
Галогенування проходить дуже легко. При бромуванні, наприклад, утворюється α-бромонафтален, а при надлишку брому утворюється суміш 1,4- та 1,5- дибромонафталенів. Реакція галогенування проходить при 50-70°С за механізмом приєднання-відщеплення: спочатку молекула галогену приєднується (у положення 1,4), а потім відбувається дегідрогалогенування.
При застосуванні таких каталізаторів, як FeCl3, галогенування проходить за механізмом електрофільного заміщення:
![{\displaystyle {\ce {C10H7-H + Cl2 + FeCl3 -> [C10H7-HCl]+ + FeCl4-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9c43900007468a49080a73c95089cd4848bcb6b1)
![{\displaystyle {\ce {[C10H7-HCl]+ + FeCl4- ->C10H7-Cl + HCl + FeCl3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e4c17203a26d1a4f387d383775faff28b2df4af9)
При цьому у кінцевому продукті 90-95% α-ізомеру.
Нітрування
Нітрування проводять 100% нітратною кислотою у присутності сульфатної кислоти при 50-60°С. Вміст β-нафталену не перевищує 5%. Друга нітрогрупа заміщує атом гідрогену у іншому кільці, у положеннях 5 (33% ) та 8 (67%), оскільки нітрогрупа є електроноакцепторною і дезактивує перше кільце.
Сульфування
При сульфуванні за температури 80°С утворюється α-нафталенсульфонова кислота, яка при нагріванні до 160°С переходить у β-ізомер.
Це пов'язано з тим, що α-ізомер утворюється з більшою швидкістю, проте β-ізомер є більш стабільним. При 80°С напрямок реакції залежить від швидкості, тобто це умови кінетичного контролю. За умов термодинамічного контролю утворюється біль стійка β-нафталенсульфонова кислота.
Ацилювання
Ацилюється нафтален легше за бензен та толуен. Каталізатором може бути хлорид алюмініюю. Який утворюється ізомер — залежить від розчинника: при застосуванні сірковуглецю утворюється α-ізомер, а при застосуванні нітробензену — β-ізомер.
Нуклеофільне заміщення
Для реакцій нуклеофільного заміщення також характерне утворення переважно α-похідних. Похідні нафталену вступають у ці реакції краще, ніж сам нафтален. Може взаємодіяти з амідом натрію (NaNH2), що невластиво незаміщеному бензену.
Приєднання
Внаслідок меншої ароматичності та більшої ненасиченості порівняно з бензеном, нафтален легше, ніж бензен, входить до реакцій приєднання. Водень приєднує у присутності нікелю. При 200°С утворюється 1,2,3,4 - тетрагідронафталін (тетралін), а при 300°С всі зв'язки насичуються.
Може також приєднувати дієнофіли.
Окиснення
Окиснюється нафтален легше, ніж бензен. Під дією хромової суміші при 25°C утворюється 1,4-нафтохінон. При окисненні 2-метилнафталену окиснюється лише ядро, а CH3-група залишається, на відміну від толуену.
У присутності оксиду ванадію(V) утворюється фталевий ангідрид:
Застосування
Свого часу нафтален застосовували як інсектицид, зокрема, для боротьби з міллю: одяг для тривалого зберігання пересипали нафталеном. Звідси походить фразеологізм «витягти з нафталіну».
У XXI сторіччі нафтален знаходить основне застосування в хімічному синтезі як сировина для отримання фталевого ангідриду, декаліну, тетраліну, нафтолів, нафтиламінів тощо, в синтезі азобарвників, поверхнево-активних речовин, репелентів, пластифікаторів.
Токсичність
Нафтален подразнює очі, вдихання нафталену призводить до гемолізу. У важких випадках зв'являється гемоглобінурія (поява гемоглобіну у сечі) та метгемоглобінемія (поява великої кількості метгемоглобіну у крові).
За класифікацією IARC, належить до канцерогенів групи 2B.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||











