
Оксид азоту(I)
| Оксид азоту(I) | |
|---|---|
|
Резонансна структура оксиду
| |
| |
| Інші назви | геміоксид азоту |
| Ідентифікатори | |
| Номер CAS | 10024-97-2 |
| Номер EINECS | 233-032-0 |
| DrugBank | 06690 |
| KEGG | D00102 і C00887 |
| ChEBI | 17045 |
| RTECS | QX1350000 |
| Код ATC | N01AX13 |
| SMILES | N#[N+][O-] |
| InChI | InChI=1S/N2O/c1-2-3 |
| Номер Бельштейна | 8137358 |
| Номер Гмеліна | 2153410 |
| Властивості | |
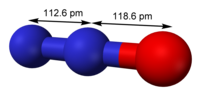
| Молекулярна формула | N2O |
| Молярна маса | 44,012 г/моль |
| Зовнішній вигляд | безбарвний газ |
| Запах | солодкуватий |
| Густина | 1,799 г/л |
| Тпл | -90,8 °C |
| Ткип | -88,49 °C |
| Діелектрична проникність (ε) | 1,00104 (20 °C) |
| Показник заломлення (nD) | 1,238 |
| В'язкість | 10,0μПа·с (200 °K) 15,0μПа·с (300 °K) 19,4μПа·с (400 °K) 23,6μПа·с (500 °K) 27,4μПа·с (600 °K) |
| Структура | |
| Дипольний момент | 0,16083 D |
| Термохімія | |
|
Ст. ентальпія утворення ΔfH 298 |
81,6 кДж/моль |
|
Ст. ентропія S 298 |
220,0 Дж/(моль·K) |
|
Теплоємність, c p |
38,6 Дж/(моль·K) |
| Небезпеки | |
| ГДК (Україна) | 90 мг/м³ |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Окси́д азо́ту(I), нітроге́н(I) окси́д — неорганічна сполука складу N2O. За звичайних умов є безбарвним газом із солодкуватим запахом. Він може підтримувати горіння; проявляє слабкі окисні та відновні властивості.
Речовина застосовується у медицині для короткочасного наркозу, а також як піноутворювач у харчовій промисловості.
Зміст
Отримання
Оксид азоту(I) вперше був отриманий у 1772 році Джозефом Прістлі при термічному розкладанні сухого нітрату амонію:
Розкладання починається за температури 170 °C і далі продовжується із виділенням великої кількості тепла, тому для уникнення надмірно бурхливого ходу реакції нагрівання треба припинити. В іншому випадку, при перегріванні суміші понад 250 °C, нітрат розкладатиметься із утворенням азоту або оксиду азоту(II).
Сучаснішою модифікацією методу Прістлі є розкладання водного розчину нітрату амонію у присутності хлоридів. За цим способом крізь концентровану (30—100 %) нітратну кислоту пропускається аміак. В результаті їхньої взаємодії утворюється нітрат амонію, що розкладається нагріванням. Тепло, що виділяється у подальшому, підвищує температуру реакційної суміші до 100—160 °C. Реакційна рівноважна суміш складається з 30—35 % нітратної кислоти, 30—50 % нітрату амонію, 15—55 % води. В реактор також додають незначну кількість (0,01—0,1 %) хлоридів та, за необхідності, сполуки мангану, нікелю, плюмбуму, бісмуту, церію — вони виступають в ролі каталізатора реакції.
Хімічні властивості
При нагріванні оксид азоту розкладається з виділенням азоту:
В атмосфері оксиду деякі метали і неметали згоряють так само активно, як і в кисні, але для ініціювання реакції необхідне високотемпературне нагрівання:
Із воднем та аміаком оксид N2O утворює вибухонебезпечні суміші:
Окрім окисних властивостей, може також проявляти і відновні:
Застосування
Основна частина синтезованого оксиду азоту(I) використовується у медицині як легке знеболювальне. У харчовій промисловості речовина застосовується як піноутворювач.
При коронавірусній хворобі 2019
Опубліковані дані відносно лікування хворих на тяжкий гострий респіраторний синдром 2002—2004 років свідчать про потенційну роль оксиду азоту, що вдихається, як допоміжний захід для лікування пацієнтів з легеневими ускладненнями. Лікування ним знизило легеневу гіпертензію, зменшило виражену гіпоксію та скоротило тривалість вентиляційної підтримки порівняно з відповідними контрольними пацієнтами з ГРВІ. Наразі проводиться 2 фаза клінічного дослідження дії препарату у пацієнтів з коронавірусною хворобою 2019 з метою запобігання прогресування хвороби у хворих з тяжким перебігом.
Див. також
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Handbook of Preparative Inorganic Chemistry / G. Brauer. — 2nd. — New York : Academic Press, 1963. — Vol. 1. — 1859 p. (англ.)
- Thiemann M., Scheibler E., Wiegand K. W. Nitric Acid, Nitrous Acid, and Nitrogen Oxides // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 42—43. — DOI:10.1002/14356007.a17_293. (англ.)
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
Посилання
- ЗАКИС АЗОТУ [Архівовано 13 березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
- Веселящий газ // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.








