
Оксид арсену(III)
| Оксид арсену(III) Білий миш'як | |
|---|---|

| |
| Ідентифікатори | |
| Номер CAS | 1327-53-3 |
| Номер EINECS | 215-481-4 |
| DrugBank | 01169 |
| KEGG | D02106 |
| Назва MeSH | D01.075.038 і D01.650.550.125 |
| ChEBI | 30621 |
| RTECS | CG3325000 |
| Код ATC | L01XX27 |
| SMILES | O=[As]O[As]=O |
| InChI | InChI=1S/As2O3/c3-1-5-2-4 |
| Номер Гмеліна | 35185 |
| Властивості | |
| Молекулярна формула | As2O3 |
| Молярна маса | 197.841 |
| Густина | 3.74 |
| Небезпеки | |
| ГДК (Україна) | 0.01 мг/м³ |
| ЛД50 | 14,6 мг/кг (пацюки, орально) |
| Головні небезпеки | надзвичайно токсичний |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Оксид арсену(III) — неорганічна сполука з хімічною формулою As2O3, що є цінною хімічною сировиною для отримання інших похідних арсену, зокрема арсеновмісних органічних сполук. Валовий обсяг виробництва в світі — 50 000 т/рік . Однак безпека його застосування в багатьох галузях сумнівна через високу токсичність.
Зміст
Отримання і властивості
Оксид арсену(III) можна отримати багатьма способами, зокрема окисленням (горінням) арсену і його похідних на повітрі. Показова реакція розкладу аурипігменту, сульфіду арсену :
Більшість, однак, є побічним продуктом інших виробництв — золотодобування й отримання міді, де він виділяється під час прожарення на повітрі, що призводило до численних масових отруєнь. Нині інтенсивний видобуток арсенових руд ведеться тільки в Китаї.
Оксид миш'яку(III) є амфотерним оксидом, його розчин має слабокислу реакцію. У лужних розчинах утворює арсеніти, в концентрованій хлоридній кислоті дає хлорид арсену(III).

Тільки деякі окислювачі — озон, пероксид водню, нітратна кислота — здатні перетворити його на оксид арсену(V) As2O5 або — при зниженні концентрації — арсин (AsH3), залежно від умов реакції.

Структура
У рідкому й газоподібному (до 800 °C) станах має формулу As4O6 (у формі димеру) і ізоструктурний P4O6. При нагріванні понад 800 °C As4O6 розпадається на молекули As2O3, схожий за будовою з N2O3. У твердому стані співіснують три поліморфних форми: кубічний молекулярний As4O6 і дві полімерні форми. Полімери, що утворюють при охолодженні монокристали, нагадують пірамідальну структуру AsO3 зі спільними атомами кисню.

|

|
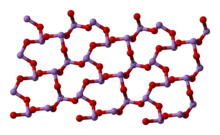
|
|
(кубічна) |
(моноклінна) |
(моноклінна) |
Використання
Оксид арсену(III) використовується для виготовлення кольорового скла, також застосовується в лісохімії й електротехніці напівпровідників, отримання чистого арсену та його сполук, таких як какодилат натрію і арсенід натрію.
У сполуці з ацетатом міді(II) триоксид утворює барвник — паризьку зелень, яку нині не використовують через надзвичайну токсичність.
Застосування в медицині
Використовується з найдавніших часів у китайській медицині, а також (від XIX століття) в гомеопатії. У конвенційній медицині триоксид арсену використовують для лікування злоякісних пухлин, таких як лейкемія, проте, зважаючи на високі ризики його застосування, перевагу надають іншим препаратам.
Також триоксид арсену успішно лікує автоімунні захворювання, взаємодіє з ферментом тіоредоксинова редуктаза.
Виявлення в природі
As2O3 міститься в арсеноліті й клаудетиті.
Токсикологія
Оксид арсену(III) отруйний. Токсичність триоксиду стала легендарною і широко описана в літературі.
В Австрії жили «миш'якоїди», які одержували дози, що в багато разів перевищують смертельну, без особливої шкоди для здоров'я. Вважається, що миш'як підвищує працездатність, особливо під час роботи на великих висотах.
ГДК для неорганічних сполук арсену, включно з As2O3, становить 0.01 мг/м³.
Напівлетальна доза — 19,1 мг/кг.
Посилання
- Solubility of As2O3 in water as function of temperature
- Case Studies in Environmental Medicine: Arsenic Toxicity [Архівовано 8 травня 2020 у Wayback Machine.]
- IARC Monograph — Arsenic and Arsenic Compounds
- International Chemical Safety Card 0378 [Архівовано 30 вересня 2007 у Wayback Machine.]
- NIOSH Pocket Guide to Chemical Hazards [Архівовано 11 травня 2017 у Wayback Machine.]
- NTP Report on Carcinogens — Inorganic Arsenic Compounds [Архівовано 11 листопада 2005 у Wayback Machine.]
- Use of Arsenic Trioxide in Multiple Myeloma Treatment
- The use of Arsenic trioxide in medicine [Архівовано 12 квітня 2006 у Wayback Machine.] .
- Institute of Chemistry Austria, speciallised on arsenic and various arsenic compounds
|
