
Оксид ванадію(V)
| Оксид ванадію(V) | |
|---|---|
| |

| |
| Назва за IUPAC | ванадій(V) оксид, диванадій пентаоксид |
| Інші назви | ванадієвий ангідрид |
| Ідентифікатори | |
| Номер CAS | 1314-62-1 |
| Номер EINECS | 215-239-8 |
| KEGG | C19308 |
| ChEBI | 30045 |
| RTECS | YW2450000 |
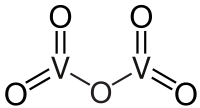
| SMILES | O=[V](=O)O[V](=O)=O |
| InChI | InChI=1S/5O.2V |
| Номер Гмеліна | 82259 |
| Властивості | |
| Молекулярна формула | V2O5 |
| Молярна маса | 181,880 г/моль |
| Зовнішній вигляд | жовто-коричневі кристали |
| Густина | 3,35 г/см³ |
| Тпл | 670 °C |
| Ткип | 1800 °C (розкл.) |
| Розчинність (вода) | 0,7 г/кг |
| Структура | |
| Кристалічна структура | ортогональна |
| Термохімія | |
|
Ст. ентальпія утворення ΔfH 298 |
-1550 кДж/моль |
|
Ст. ентропія S 298 |
130 Дж/(моль·K) |
|
Теплоємність, c p |
130,6 Дж/(моль·K) |
| Небезпеки | |
| R-фрази | Шаблон:R20/22, R37, Шаблон:R48/23, R51/53, Шаблон:R63, R68 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Окси́д вана́дію(V), вана́дій(V) окси́д — неорганічна сполука ряду оксидів складу V2O5. За звичайних умов — жовто-коричневий порошок, малорозчинний у воді. Речовина є токсичною. Проявляє амфотерні властивості з переважанням кислотних.
Оксид ванадію — найважливіша ванадієвмісна сполука. Він застосовується у виготовленні каталізаторів, спеціального скла, пігментів.
Зміст
Поширення у природі
Оскільки оксид ванадію легко утворює гідрати, у мінеральних покладах він перебуває саме у сполученні з водою — для нього відомі гідрати алаїт V2O5·H2O і навахоїт V2O5·3H2O.
Також він входить до складу природних ванадатів: ванадиніту 3Pb3(VO4)2·PbCl2, карнотиту K2(UO2)2[VO4]2·3H2O, деклуазиту (Zn,Cu)Pb(VO4)(OH), ферваніту FeVO4·2H2O, пухериту BiVO4 тощо.
Фізичні властивості
Оксид ванадію — отруйний порошок без запаху і смаку. Його колір коливається від помаранчево-жовтого до цегляно-коричневого. При охолодженні з рідкого стану він кристалізується у червонуваті ромбічні голки за слабкими парамагнітними властивостями.
Оксид ванадію займає проміжне положення у порівнянні з вищими оксидами 4 і 6 груп свого періоду — TiO2 і CrO3. Зокрема, він є менш температурно стійким, аніж оксид титану, і стійкішим за оксид хрому.
Отримання
Основним способом синтезу оксиду ванадію є термічне розкладання ванадатів амонію на повітрі:
Також застосовується спалювання порошку ванадію у струмені кисню під тиском:
Менш поширеними способами є термічне розкладання і гідроліз сполук ванадилу:
Хімічні властивості
Оксид ванадію(V) є відносно малостійким оксидом, при нагріванні він плавиться і розкладається — із утворенням оксиду ванадію(IV):
-
(домішки V6O13)
Він практично не реагує з водою, із розчину осаджується у вигляді гідрату V2O5·nH2O (n=1, 2, 3).
У взаємодіях оксид проявляє амфотерні властивості, зі значною перевагою кислотних. V2O5 є більш кислотним оксидом і сильнішим окисником, ніж сусідній оксид титану(IV), але слабшим, ніж оксид хрому(VI).
Окрім катіонів ванадилу у сильнокислих розчинах і ортованадат-аніонів у сильнолужних, у розчинах проміжної кислотності можуть також утворюватися частинки (VO3)-, (HVO4)2-, (V3O9)3-, (V4O12)5-, (V10O28)6- та інші.
При нагріванні оксид взаємодіє з воднем, хлором, телуром, оксидом сірки(IV):
Остання реакція є важливою стадією у каталітичному виробництві сульфатної кислоти.
Ванадій з оксиду відновлюється лише при дії кальцію, тоді як з алюмінієм утворюється сплав V—Al.
Важливим ванадієвмісним сплавом є ферованадій, котрий добувають спільним відновленням V2O5 і Fe2O3:
Токсичність
Оксид ванадію(V) є небезпечним. Його вдихання серйозно подразнює дихальні шляхи, що може супроводжуватися задишкою і астмою, негативним впливом на легені. Проковтування речовини є потенційно смертельним, потрапивши до організму, вона впливає на ЦНС. При контакті за шкірою може спостерігатися алергічна реакція. Оксид ванадію класифікується як потенційний канцероген.
Застосування
Оксид ванадію широко використовується в ролі каталізатору для гомогенного і гетерогенного каталізу — у виробництві сульфатної кислоти, фталевого і малеїнового ангідридів, адипінової та акрилової кислот. Також незначні кількості йдуть на отримання щавелевої кислоти й антрахінону.
Він є складовою спеціального скла, що затримує ультрафіолетове випромінювання, також застосовується у виготовленні пігментів (жовтого SnO2/V2O5 і синього ZrO2/V2O5) та як антистатичний шар у фотографічних матеріалах.
Див. також
Посилання
- Vanadium(V) oxide. Material Safety Data Sheet — Clayton State Univercity [недоступне посилання з листопадаа 2019](англ.)
Джерела
- Patnaik, P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8. (англ.)
- Woolery, M. Chromium Compounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 6. — P. 134. — ISBN 978-0-471-48517-9. — DOI:10.1002/0471238961.2201140123151512.a01. (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Bauer, G. et al. Vanadium and Vanadium Compounds // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 15. — DOI:10.1002/14356007.a27_367. (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / Под ред. В. И. Спицына. — М. : «Мир», 1972. — Т. 2. — С. 142—143, 167—170. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)



















