
ZMapp
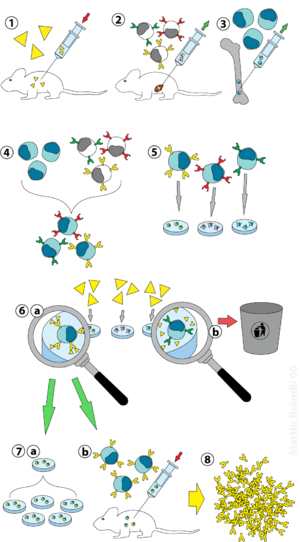
(1) імунізація тварин;
(2) виділення В-лімфоцитів із селезінки;
(3) культура клітин мієломи;
(4) злиття В-лімфоцитів і клітин мієломи;
(5) сегрегація клітинних ліній;
(6) скринінг та селекція ліній виробництва антитіл;
(7) розмноження гібридоми in vitro (a) або in vivo (b);
(8) отримання антитіл.
ZMapp — це експериментальний біофармакологічний препарат, до складу якого входять 3 химерні моноклональні антитіла, який розроблений для лікування геморагічної гарячки Ебола. Два із трьох компонентів початково розроблені в Національній Мікробіологічній Лабораторії Агентства з охорони здоров'я Канади, третій компонент розроблений у Дослідницькому центрі інфекційних хвороб Армії США у Форт Детріку, суміш оптимізована Гарі Кобінгером, колишнім керівником відділу канадської Національної Мікробіологічної Лабораторії, подальше дослідження препарату проводилось згідно ліцензії компанії «Mapp Biopharmaceutical». ZMapp уперше застосовувався для лікування людей під час епідемії гарячки Ебола в Західній Африці у 2014—2016 роках, попередньо проводилися дослідження препарату на тваринах, проте ZMapp не проходив рандомізованих контрольованих досліджень.Національний інститут охорони здоров'я США (NIH) розпочав клінічні дослідження препарату, які розпочались у січні 2015 року, в яких брали участь 200 осіб з Сьєрра-Леоне, Ліберії та Гвінеї, проте у зв'язку із їх проведенням на фоні епідемічного спалаху хвороби їх результати виявилися змазаними, та не змогли дати точної відповіді щодо ефективності ZMapp у лікуванні геморагічної гарячки Ебола, у зв'язку із чим дослідження було достроково припинене.
Зміст
Хімічний склад
Препарат складається з трьох химерних моноклональних антитіл, гуманізованих від мишей, до білків вірусу Ебола. Цими компонентами є химерні моноклональні антитіла c13C6 із попередньо приготованої суміші антитіл «MB-003», і два інших антитіла із суміші, яка отримала назву ZMab — c2G4 і c4G7. ZMapp виробляється в рослині роду тютюн Nicotiana benthamiana шляхом особливої технології біопродукції на підприємстві «Kentucky BioProcessing», яке є частиною компанії «Reynolds American».

Механізм дії
Подібно до імуноглобулінів для внутрішньовенного введення, ZMapp містить суміш нейтралізуючих антитіл, які продукують пасивний імунітет, збільшуючи індивідуальну імунну відповідь, та розроблені для застосування у випадку інфікування вірусом гарячки Ебола. Такі антитіла можуть застосовуватися для лікування та профілактики багатьох інфекційних захворювань, і призначаються у випадку спалаху вірусної інфекції при перших ознаках захворювання для запобігання важкого перебігу захворювання та профілактики можливих ускладнень.
Історія
Два із трьох компонентів початково розроблені в Національній Мікробіологічній Лабораторії Агентства з охорони здоров'я Канади, третій компонент розроблений у Дослідницькому центрі інфекційних хвороб Армії США у Форт Детріку, суміш оптимізована Гарі Кобінгером, колишнім керівником відділу канадської Національної Мікробіологічної Лабораторії, подальші дослідження препарату проводились у дослідницькому центрі «Leaf Biopharmaceutical» («LeafBio, Inc.»), підрозділі компанії «Mapp Biopharmaceutical», розміщеному в Сан-Дієго. «LeafBio» розробила ZMapp разом із батьківською компанією і «Defyrus Inc», і після отримання даної суміші антитіл отримала на неї ліцензію, надавши їй назви MB-003 and ZMab.
MB-003
MB-003 — це суміш гуманізованих (від миші) химерних моноклональних антитіл: c13C6, h13F6 і c6D8. Згідно досліджень, опублікованих у вересні 2012 року, виявлено, що макаки резус, інфіковані вірусом гарячки Ебола, виживають після введення їм MB-003 (суміші із трьох химеричних моноклональних антитіл) протягом 1 години після інфікування. У випадку введення цієї суміші протягом 24—48 годин після інфікування виживають 4 із 6 тварин, окрім того, зменшується вірусемія, гарячка, послаблюються клінічні симптоми захворювання. MB-003 розроблений науковцями Дослідницького центру інфекційних хвороб Армії США Джин Олінджер і Джеймсом Петтіттом у співпраці з компанією «Mapp Biopharmaceutical» за участю фондів урядових агентств США, зокрема Національного інституту інфекційних та алергічних захворювань, Центру сучасних біомедичних досліджень і розвитку, та Агентства зі скорочення військової загрози.>
ZMAb
ZMAb — це суміш трьох мишачих моноклональних антитіл: m1H3, m2G4 та m4G7. Згідно результатів досліджень, опублікованих у листопаді 2013 року, макаки, інфіковані вірусом гарячки Ебола, виживали після ін'єкції суміші 3 моноклональних антитіл (ZMAb) до поверхневого глікопротеїну вірусу Ебола, якщо ін'єкція проводилась не більш ніж за 24 години після інфікування. Автори дослідження зробили висновок, що застосування даної суміші моноклональних антитіл призводить до посилення імунної відповіді, яка захищає від інфікування вірусом, яка збільшується протягом 10 тижнів та утримується протягом 13 тижнів. ZMab розроблений у Національній Мікробіологічній Лабораторії Канади, та ліцензований компанією з біологічного захисту «Defyrus», розміщеній у Торонто, із залученням коштів Агентства з охорони здоров'я Канади.
ZMapp
Згідно документів, опублікованих у 2014 році, «Mapp Biopharmaceutical» та її партнери, зокрема Агентство з охорони здоров'я Канади, «Kentucky BioProcessing» та Національний інститут інфекційних та алергічних захворювань у пошуку найбільш ефективної комбінації антитіл проти вірусу Ебола проводили дослідження суміші химерних моноклональних антитіл, до якої входили антитіла c13C6 із суміші MB-003, та два антитіла із суміші ZMAb — c2G4 and c4G7. Дана суміш спочатку тестувалась на морських свинках, а пізніше на приматах. Саме цей препарат і отримав назву ZMapp.
Згідно даних клінічного дослідження препарату, опублікованому в 2014 році, у ньому брали участь 21 макака резус. Усі тварини під час проведення досліджень були інфіковані кіквітським варіантом вірусу Ебола, поширеним у Демократичній Республіці Конго. Три примати отримали неактивні до вірусу антитіла, та склали контрольну групу. Решта 18 макак склали групу, яка отримувала лікарський препарат. Під час дослідження група, яка отримувала лікарський препарат, розділена на 3 підгрупи по 6 тварин. Усі тварини із групи, яка отримувала лікування, отримали по 3 дози ZMapp з інтервалом у 3 дні. Першій підгрупі макак із групи, що отримувала лікування, першу дозу препарату вводили на 3 добу після інфікування вірусом Ебола; другій підгрупі на 4 добу; а третій підгрупі на 5 добу після інфікування вірусом. Усі тварини з контрольної групи загинули, натомість усі 18 тварин із групи, яка отримувала лікування, вижили. У подальших дослідженнях компанії «Mapp Biopharmaceutical» виявилось, що ZMapp зупиняє реплікацію гвінейського штаму вірусу Ебола у клітинній культурі.
«Mapp Biopharmaceutical» вирішила продовжувати виробництво препарату відповідно з контрактом із підприємством «Kentucky BioProcessing», яке є частиною компанії «Reynolds American». У процесі виробництва препарату генотип химеричних моноклональних антитіл включався до вірусних векторів, і рослини тютюну інфікувалися вірусними векторами із включенням генокоду антитіл, із використанням культури бактерій Agrobacterium. Пізніше антитіла виділяються з рослин та очищаються. Оскільки включення до генотипу химеричних антитіл проводиться вручну, то виробництво препарату із використанням рослин тютюну триває кілька місяців. Розвиток цього методу виробництва ZMapp фінансувався Агентством передових оборонних дослідницьких проектів США як частина його заходів із боротьби з бактеріологічними загрозами, розпочаті після терористичних актів 11 вересня 2001 року.
Застосування під час епідемії гарячки Ебола у Західній Африці в 2014—2016 роках
ZMapp уперше застосовувався у клінічній практиці під час епідемії гарячки Ебола в Західній Африці в 2014 році без попередніх клінічних досліджень у людей, які могли б підтвердити ефективність препарату або виявити потенційні ризики його застосування. У жовтні 2014 року FDA дозволив використання кількох експериментальних препаратів, зокрема ZMapp, для застосування в осіб, інфікованих вірусом Ебола. Всесвітня організація охорони здоров'я визнала застосування експериментальних ліків під час епідемії етичним. У 2014 році незначна кількість препарату застосовувалась для лікування 7 осіб, інфікованих вірусом Ебола, з яких 2 померли. Результати застосування ZMapp визнані статистично недостовірними. «Mapp Biopharmaceutical» у серпні 2014 року анонсувала, що використання ZMapp буде призупинене.
Суперечки щодо етичності застосування
Відсутність ліків та недоступність експериментального лікування в найбільш уражених епідемією регіонах Африки спричинила низку дискусій. Факт, що найновіші ліки уперше застосовувались для лікування білих американців та європейців, а не африканців, на думку газети Los Angeles Times, «спровокували обурення, спричинене на думку африканців байдужістю та пихатістю європейців щодо корінного населення Африки, а в підсвідомості африканців пов'язане із недовірою до європейців, спричиненою зрадницькою політикою щодо корінних африканців, що відсилає їх до спогадів щодо експлуатації та жорсткого поводження з ними у колоніальну еру».Салім Абул Карім, директор Південно-Африканського центру досліджень СНІДу, у контексті історії щодо експлуатації та жорстокого поводження з корінними африканцями в колоніальну еру, висловився наступним чином: «Слід повторити основну кричущу подію останніх днів: африканці використовуються як морські свинки американськими фармацевтичними компаніями» (англ. It would have been the front-page screaming headline: 'Africans used as guinea pigs for American drug company's medicine').
На початку серпня 2014 року Всесвітня організація охорони здоров'я оголосила про скликання наради провідних спеціалістів для визначення етичності широкого застосування експерментальних препаратів. У офіційному звіті цієї наради її учасники, зокрема Петер Піот (один із провідних дослідників вірусу Ебола), Джеремі Фаррар (директор «Wellcome Trust») і Девід Гейманн (Центр світової безпеки здоров'я Королівського інституту міжнародних відносин), висловились за продовження застосування експериментальних препаратів в уражених епідемією регіонах Західної Африки.
6 серпня 2014 року президент США Барак Обама на своїй прес-конференції висловився за продовження застосування ZMapp та інших експериментальних ліків для лікування хворих за межами США.
Клінічні дослідження
Національний інститут охорони здоров'я США 27 лютого 2015 року повідомив про початок рандомізованих контрольованих досліджень ZMapp на хворих гарячкою Ебола в Ліберії та США. 72 особи, інфіковані вірусом Ебола, залучені до клінічних досліджень з березня до листопада 2015 року, дослідницька група припинила залучення нових осіб до дослідження у січні 2016 року, не виконавши заплановане раніше залучення до 200 осіб, у зв'язку із тим, що результати дослідження виявились змазаними на фоні великої епідемії захворювання. Згідно із результатами досліджень, застосування ZMapp на 40 % знижувало ризик смерті від гарячки Ебола, проте дані результати не визнано статистично достовірними, та не підтверджено, що включення препарату до схеми лікування гарячки Ебола покращує результат лікування. Проте за результатами досліджень застосування ZMapp визнано безпечним та таким, яке добре переносилось хворими.
Застосування під час епідемії в Демократичній Республіці Конго в 2018 році
Використання ZMapp для невідкладного застосування визнано Всесвітною організацією охорони здоров'я відповідним етичному протоколу застосування незареєстрованих та експериментальних лікарських препаратів. Група спеціалістів з лікування гарячки Ебола висловила думку, що користь від застосування препарату переважає ризики можливих ускладнень, проте при його застосуванні необхідно ретельно дотримуватися правил зберігання та транспортування препарату, зокрема дотримання холодового ланцюга при зберіганні та транспортуванні препарату. Чотири альтернативні лікарські препарати (ремдесивір, REGN3470-3471-3479, фавіпіравір, та mAb114) також допущені для лікування гарячки Ебола, проте виключно на ранніх стадіях розвитку хвороби.
Див. також
Посилання
- Madelain, Vincent; Nguyen, Thi Huyen Tram; Olivo, Anaelle; Lamballerie, Xavier de; Guedj, Jérémie; Taburet, Anne-Marie; Mentré, France (21 січня 2016). Ebola Virus Infection: Review of the Pharmacokinetic and Pharmacodynamic Properties of Drugs Considered for Testing in Human Efficacy Trials. Clinical Pharmacokinetics (англ.) 55 (8): 907–923. ISSN 0312-5963. PMID 26798032. doi:10.1007/s40262-015-0364-1. Архів оригіналу за 18 серпня 2016. Процитовано 21 липня 2016. (англ.)