CREB
CREB-TF (CREB, cAMP response element-binding protein) — клітинний фактор транскрипції. Він зв’язується з певними послідовностями ДНК, які називаються елементами відповіді цАМФ (CRE), тим самим збільшуючи або зменшуючи транскрипцію генів.
CREB був вперше описаний у 1987 році як цАМФ-чутливий фактор транскрипції, що регулює ген соматостатину.
Гени, транскрипція яких регулюється CREB, включають: c-fos, BDNF, тирозингідроксилазу, численні нейропептиди (такі як соматостатин, енкефалін, VGF, кортикотропін-рилізинг-гормон), і гени, залучені до циркадного годинника ссавців (PER1, PER2).
CREB за структурою та функціями тісно пов’язаний з білками CREM (модулятор елемента відповіді цАМФ) і ATF-1 (активуючий фактор транскрипції-1). Білки CREB експресуються у багатьох тварин, включаючи людей.
CREB відіграє велику роль у пластичності нейронів і формуванні довгострокової пам’яті в мозку, а також було показано, що він є невід’ємною частиною формування просторової пам’яті.
Зниження регуляції CREB пов’язане з патологією хвороби Альцгеймера, і збільшення експресії CREB розглядається як можлива терапевтична мішень для хвороби Альцгеймера.
Зміст
Підтипи
Наступні гени кодують CREB або CREB-подібні білки:
- CREB1 кодує білок CREB1
- CREB2 кодує білок CREB2 (перейменовано на ATF4)
- CREB3 кодує білок CREB3
- CREB5 кодує білок CREB5
- CREB3L1 кодує білок CREB3L1
- CREB3L2 кодує білок CREB3L2
- CREB3L3 кодує білок CREB3L3
- CREB3L4 кодує білок CREB3L4
Структура
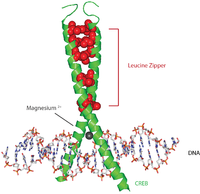
Білки CREB активуються шляхом фосфорилювання з різних кіназ, включаючи PKA, і Ca2+/кальмодулін-залежні протеїнкінази на залишку Serine 133. Після активації білок CREB залучає інші коактиватори транскрипції для зв’язування з промотором CRE 5', розташованим вище. Гідрофобні амінокислоти лейцину розташовані вздовж внутрішнього краю альфа-спіралі. Ці залишки лейцину міцно зв’язуються із залишками лейцину іншого білка CREB, утворюючи димер. Цей ланцюжок залишків лейцину утворює мотив лейцинової застібки. Білок також містить іон магнію, який сприяє зв’язуванню з ДНК.
Елемент відповіді cAMP
Елемент відповіді cAMP (CRE) є елементом відповіді на CREB, який містить висококонсервативну послідовність нуклеотидів 5'-TGACGTCA-3'. Сайти CRE, як правило, знаходяться вище генів, у промоторних або енхансерних областях. У геномі людини існує приблизно 750 000 паліндромних і половинних CRE. Однак більшість цих ділянок залишаються незв’язаними через метилювання цитозину, яке фізично перешкоджає зв’язуванню білка.
Механізм дії
Типова (хоча й дещо спрощена) послідовність подій виглядає наступним чином: сигнал надходить на поверхню клітини, активує відповідний рецептор, що призводить до виробництва вторинного посередника, такого як цАМФ або Ca 2+, який, у свою чергу, активує протеїнкіназу. Ця протеїнкіназа переміщується до клітинного ядра, де активує білок CREB. Потім активований білок CREB зв’язується з ділянкою CRE, а потім зв’язується з CBP (білком, що зв’язує CREB), який коактивує його, дозволяючи йому вмикати або вимикати певні гени. Зв’язування ДНК CREB здійснюється через його основний домен лейцинової застібки (домен bZIP), як показано на зображенні. Докази свідчать про те, що β-адренорецептор (рецептор, зв’язаний з G-білком) стимулює передачу сигналів CREB.
Функція в мозку
CREB виконує багато функцій у багатьох різних органах, і деякі з його функцій були вивчені у зв’язку з мозком.
Вважається, що білки CREB у нейронах беруть участь у формуванні довготривалої пам’яті; це було показано на морських равликах Aplysia, плодовій мушці Drosophila melanogaster, на щурах і мишах (див. CREB в пізнанні). CREB необхідний для пізньої стадії довготривалої потенціації. CREB також відіграє важливу роль у розвитку наркоманії і тим більше психологічної залежності.
Розрізняють активаторну і репресорну форми CREB. Мухи, генетично створені для надмірної експресії неактивної форми CREB, втрачають здатність зберігати довготривалу пам’ять. CREB також важливий для виживання нейронів, як показано на генетично модифікованих мишах, де CREB і CREM були видалені в мозку. Якщо CREB втрачається у всьому ембріоні миші, що розвивається, миші гинуть відразу після народження, що знову підкреслює критичну роль CREB у сприянні виживанню нейронів.
Зв'язок із захворюваннями
Порушення функції CREB у мозку може сприяти розвитку та прогресуванню хвороби Гентінгтона.
Аномалії білка, який взаємодіє з доменом KID CREB, CREB-зв’язуючого білка (CBP), пов’язані з синдромом Рубінштейна-Тайбі.
Є деякі дані, які свідчать про те, що недостатнє функціонування CREB пов’язане з великим депресивним розладом. Депресивні щури з надмірною експресією CREB у зубчастій звивині поводилися подібно до щурів, які отримували антидепресанти. Посмертні дослідження також показали, що кора головного мозку пацієнтів із нелікованим великим депресивним розладом містить знижені концентрації CREB порівняно як зі здоровими особами контролю, так і з пацієнтами, які отримували антидепресанти. Функцію CREB можна модулювати за допомогою сигнального шляху, що є результатом зв’язування серотоніну та норадреналіну з постсинаптичними G-білковими рецепторами. Дисфункція цих нейромедіаторів також причетна до великого депресивного розладу.
Участь у циркадних ритмах
Встановлення (entrainment) циркадного годинника ссавців встановлюється через світлову індукцію PER. Світло збуджує фоточутливі гангліозні клітини сітківки, що містять меланопсин, які передають сигнал до супрахіазматичного ядра (SCN) через ретиногіпоталамічний тракт (RHT). Збудження RHT сигналізує про вивільнення глутамату, який сприймається рецепторами NMDA на SCN, що призводить до надходження кальцію в SCN. Кальцій індукує активність Ca 2+/ кальмодулін-залежних протеїнкіназ, що призводить до активації PKA, PKC і CK2. Потім ці кінази фосфорилюють CREB циркадним способом, що далі регулює експресію генів. Фосфорильований CREB розпізнає елемент відповіді cAMP і служить фактором транскрипції для Per1 і Per2, двох генів, які регулюють циркадний годинник ссавців. Ця індукція білка PER може залучати циркадний годинник до циклів світло/темрява, гальмує його власну транскрипцію через петлю зворотного зв’язку транскрипція-трансляція, яка може прискорювати або затримувати циркадний годинник. Однак реакція на індукцію білків PER1 і PER2 є значною лише під час суб’єктивної ночі.
Виявлення участі CREB у циркадних ритмах
Майкл Грінберг вперше продемонстрував роль CREB у циркадному годиннику ссавців у 1993 році за допомогою серії експериментів, які корелювали фазоспецифічні світлові імпульси з фосфорилюванням CREB. In vitro під час суб’єктивної ночі світло підвищувало фосфорилювання CREB, а не рівнів білка CREB. In vivo світлові імпульси, що викликають зсув фази, протягом суб’єктивної ночі корелювали з фосфорилюванням CREB у SCN.
Експерименти Гюнтера Шютца в 2002 році продемонстрували, що мутантні миші, у яких відсутній сайт фосфорилювання Ser142, не змогли індукувати регуляторний ген годинника mPer1 у відповідь на світловий імпульс. Крім того, ці миші-мутанти мали труднощі з привчанням до циклів світло-темрява.