DIABLO
DIABLO (англ. Diablo IAP-binding mitochondrial protein) – білок, локалізований у мітохондрії. який кодується однойменним геном, розташованим у людей на короткому плечі 12-ї хромосоми.
Задіяний у таких біологічних процесах, як апоптоз, альтернативний сплайсинг.
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MAALKSWLSR | SVTSFFRYRQ | CLCVPVVANF | KKRCFSELIR | PWHKTVTIGF | ||||
| GVTLCAVPIA | QKSEPHSLSS | EALMRRAVSL | VTDSTSTFLS | QTTYALIEAI | ||||
| TEYTKAVYTL | TSLYRQYTSL | LGKMNSEEED | EVWQVIIGAR | AEMTSKHQEY | ||||
| LKLETTWMTA | VGLSEMAAEA | AYQTGADQAS | ITARNHIQLV | KLQVEEVHQL | ||||
| SRKAETKLAE | AQIEELRQKT | QEEGEERAES | EQEAYLRED |
Зміст
Структура
Білок
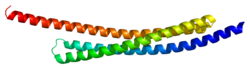
Цей ген кодує дугоподібний білок, завдовжки 130 Å що складається з двох однакових молекул. Довжина поліпептидного ланцюга білка становить 239 амінокислот, 55 з яких складають мітохондріальну сигнальну послідовність на Ν-кінці. Як тільки весь поліпептидний ланцюг імпортувався в мітохондрію, сигнальна послідовність вирізається для отримання зрілого білка з 184 амінокислот. Це розщеплення також виявляє 4 залишки на Ν-кінці, Ala-Val-Pro-Ile (AVPI), які є ядром для ΙΑP- зв'язуючих доменів і є вирішальними для інгібування білка XIAP. Зокрема тетрапептидна послідовність зв'язує домен BIR3 білку ΧΙAP для формування стабільного комплексу між DIABLO та XIAP. Структура гомодимера також полегшує зв'язування DIABLO та XIAP через домен BIR2, хоча зв'язок не формується доки білок не вивільняється в цитоплазму у результаті зовнішньої зміни проникності мемрани мітохондрії. Таким чином мономерні мутанти білка все ще можуть зв'язуватись з доменом ΒΙR3, але не з доменом BIR2, який погіршує інгібіторну функцію білка.
Ген
Ген DIABLO у ссавців містить 6 екзонів охоплює 19,86 кб геномної ДНК. Для цього гена було описано декілька алтернативних варіантів сплайсингових транскриптів., але період дії деяких транскриптів і передбачувані комбінації екзонів не визначено остаточно.
Мутації
Шляхом генетичних аналізів було визначено, що гетерозиготна мутація білка SMAC/DIABLO c.377C> T, що характеризується домінантною, прогресуючою втратою слуху, позначеною як DFNA64. DFNA64 індетифіковано як генетичне захворювання людини, пов'язане з порушенням функції SMAC / DIABLO. Мутант SMAC / DIABLOS71L може викликати мітохондріальну дисфункцію.
Фізіологічна роль
DIABLO - білок, який сприяє активації апоптозу шляхом пригнічення ефекту інгібітора білків апоптозу (ΙΑP) - протеїн, який негативно регулює апоптоз або запрограмовану смерть клітин. DIABLO - мітохондріальний білок, локалізований в мітохондріальному межмамбранному просторі, але він входить в цитозоль, коли клітини піддаються апоптозу.
Упродовж внутрішнього шляху апоптозу білки ΒCL-2, такі як BAK і BAX утворюють пори у зовнішній мітохондріальній мембрані, що призводить до проникності мітохлндріальної мембрани і вивільненню цитохрома С та DIABLO. В той час як цитохром С безпосередньо активує APAF1 і каспазу 9. DIABLO зв'язує такі білки як XIAP та cIAP для пригнічення їх каспазно-зв'язуючої активності і дозволяє каспазі активувати апоптоз. DIABLO експресується в багатьох типах клітин, бере участь в багатьох біологічних процесах, включаючи апоптоз. На даний час неапоптичні функції DIABLO залишаються незрозумілими.
Основні функції
- стимулювання апоптозу шляхом зв'язування каспаз з інгібіторами сімейства IAP;
- активування каспаз в шляху цитохром С/APAF1/CASP9;
- бере участь у TNF-опосередкованій активації CASP8 і апоптозі;
- грає важливу роль в апоптозі, який викликаний нестероїдними протизапальними препаратами під час раку товстої кишки;
- один із проапоптичних білків, який вивільняється з мітохондрій які інактивують ΙΑP і відіграють надлишкову роль під час розвитку і загибелі клітин;
- відіграє обов'язкову роль в клітинах пухлини під час декількох шляхів індукції апоптоза;
- може ставити мішень на BIRC2, щоб індукувати TNFalpha-залежний апоптоз і тому може брати участь у лікуванні раку;
- Функція DIABLO, а не активність каспази-9, була вирішальною для повної активації ефекторних каспаз;
Взаємодія з іншими білками
- PRPS1 ініціює активацію каспази перед цитохромом С і DIABLO;
- взаэмодіє з UBE2K (сприяє деградації зрілого білка DIABLO через протеасомний шлях убіквітіна);
- перешкоджає апоптозу клітин раку молочної залози шляхом пригнічення BIRC5;
- при апоптозі BIRC5 роспізнає білок DIABLO;
- BIRC6 може грати потенційну онкогенну роль при нейробластомі шляхом інактивації цитоплазматичного DIABLO;
- внутрішньомембранне розщеплення DIABLO білком PARL генерує N-кінці ΙΑP-зв'язуючого моти́ву (ділянка послідовності ДНК або білка, що зустрічається в різних генах), який необхідний для апоптотичної активації білка.
Клінічне значення
DIABLO відіграє ключову роль у діагностиці та лікуванні раку. Надмірна експресія білка пов'язана з підвищеною чутливістю клітин пухлин до апоптозу. До цього часу спостерігали надмірну експресію білка для протидії прогресуваню раку. Після експериментального визначення структури білка, були розроблені низькомолекулярні меметики DIABLO, які розвивалися для імітації тетрапептиду AVPI у IAP-зв'язуючому домені білка, який відповідає за зв'язування доменів ΒΙR3 в таких білках як XIAP, cIAP1 для індукції апоптозу і некроптозу.
Декілька з багатьох меметиків білку розроблених упродовж останнього десятиліття, таких як SM-406 і два меметики компанії Genentech проходять клінічні випробування. Ці меметики також розроблені для безпосереднього знаходження мішені на пухлинних клітинах шляхом взаємодії з запальними білками, такими як IL-1β, які зазвичай продукуються твердими пухлинними ураженнями. Доклінічні дослідження вказують на те, що використання меметиків SMAC у поєднанні з хіміотерапією, лігандами і агоністами рецепторів смерті, а також лікарськими засобами, спрямованими на невеликі молекули, підвищують чутливість пухлинних клітин до цих способів лікування. Тим не менш, все ще існує потенціал для побічних ефектів, таких як підвищений рівень цитокінів і хемокінів у нормальних тканина.
Література
- Du C., Fang M., Li Y., Li L., Wang X. (2000). Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition.. Cell 102: 33 — 42. PubMed DOI:10.1016/S0092-8674(00)00008-8
- Fu J., Jin Y., Arend L.J. (2003). Smac3, a novel Smac/DIABLO splicing variant, attenuates the stability and apoptosis-inhibiting activity of X-linked inhibitor of apoptosis protein.. J. Biol. Chem. 278: 52660 — 52672. PubMed DOI:10.1074/jbc.M308036200
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- Bartke T., Pohl C., Pyrowolakis G., Jentsch S. (2004). Dual role of BRUCE as an antiapoptotic IAP and a chimeric E2/E3 ubiquitin ligase.. Mol. Cell 14: 801 — 811. PubMed DOI:10.1016/j.molcel.2004.05.018