Moderna (вакцина)
|
Moderna (вакцина)
| |
| Систематизована назва за IUPAC | |
| Класифікація | |
| ATC-код | Немає |
| PubChem | |
| CAS | |
| DrugBank | DB15654 |
| Тип | mRNA |
| Способи введення | Внутрішньом'язова ін'єкція |
| Хімічна структура | |
| Формула | |
| Мол. маса | |
| Синоніми | mRNA-1273, CX-024414, COVID-19 mRNA Vaccine Moderna, TAK-919, Moderna COVID‑19 Vaccine, COVID‑19 Vaccine Moderna, COVID-19 Vaccine Moderna Intramuscular Injection, |
| Фармакокінетика | |
| Біодоступність | |
| Метаболізм | |
| Період напіввиведення | |
| Екскреція | |
| Реєстрація лікарського засобу в Україні | |
Вакцина Moderna проти COVID‑19 (МНН: elasomeran), кодова назва mRNA-1273 і продається під торговою маркою Spikevax, — вакцина проти COVID-19, розроблена компанією Moderna, американськими Національним інститутом алергії та інфекційних захворювань (NIAID), Управлінням з удосконалення біомедичних досліджень (BARDA). Вона дозволена для використання для людей у віці 12 років і старше в деяких країнах, а також людям віком від 18 років в інших країнах для забезпечення захисту від коронавірусної хвороби 2019, яку спричиняє вірус SARS-CoV-2. Вводиться внутрішньом'язовими ін'єкціями у вигляді курсу з двох доз по 0,5 мл; другу дозу вводять через 29 днів після першої.
Це РНК-вакцина, що складається з матричної рибонуклеїнової кислоти з модифікованими нуклеозидами (модРНК), що кодує пепломер SARS-CoV-2, який інкапсульований у ліпідних наночастинках.
Вакцина Moderna проти COVID-19 дозволена для використання на певному рівні в 53 країнах, включаючи Канаду, країни Європейської економічної зони, Сінгапур, Філіппіни, Південну Корею, Таїланд, Велику Британію та США.
15 березня 2021 року розпочалася І фаза клінічних випробувань другої вакцини Moderna проти COVID-19 (mRNA-1283).
Зміст
Медичне застосування
Вакцина Moderna проти COVID-19 використовується для захисту від зараження вірусом SARS-CoV-2 з метою запобігання коронавірусній хворобі 2019.
Вакцина вводиться внутрішньом'язово в дельтоподібний м'яз. Початковий курс складається з двох доз.Всесвітня організація охорони здоров'я (ВООЗ) рекомендує інтервал між ін'єкціями 28 днів. Дані свідчать, що ефективність першої дози зберігається до десяти тижнів. Тому, щоб уникнути смертей, коли запаси обмежені, ВООЗ рекомендує відкласти другу дозу на 12 тижнів для досягнення високого охоплення першої дози у пріоритетних групах.
Ефективність
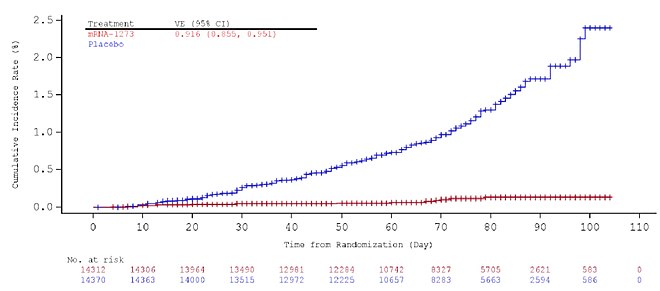
Докази ефективності вакцини з'являються приблизно через два тижні після першої дози. Висока ефективність досягається при проведенні повної імунізації через два тижні після приймання другої дози, і її оцінюють у 94,1 %: наприкінці дослідження вакцини, яке стало підставою до надання дозволу на екстрене використання в США, у групі вакцинованих було діагностовано одинадцять випадків COVID-19 (з 15 181 людини) проти 185 випадків у групі плацебо (15 170 осіб). Більше того, у групі вакцинованих було зареєстровано нуль випадків важкого перебігу COVID-19 порівняно з одинадцятьма у групі плацебо. Ця ефективність була описана як «приголомшлива» та «гранично історична» для вакцини проти респіраторних вірусів, і вона подібна до ефективності вакцини Pfizer-BioNTech проти COVID-19.
Оцінки ефективності були подібними для вікових груп, статей, расових та етнічних груп, а також учасників із супутніми захворюваннями, пов'язаними з високим ризиком тяжкого перебігу COVID-19. Досліджувались лише особи віком від 18 років. Тривають дослідження щодо оцінки ефективності та безпеки у дітей віком від 0 до 11 років (KidCOVE) та 12-17 років (TeenCOVE).
Подальше дослідження, проведене Центрами з контролю та профілактики захворювань у США (CDC) у період з грудня 2020 року до березня 2021 року, серед майже 4 тисяч медичних працівників, осіб, які надають першу медичну допомогу, та інших важливих та пов'язаних з інфекцією працівників, дійшли висновку, що в реальних умовах ефективність повної імунізації за допомогою мРНК-вакцинації (14 днів або більше після другої дози) становила 90 % проти інфекцій SARS-CoV-2, незалежно від симптомів, а ефективність вакцини від часткової імунізації (14 днів або більше після першої дози, але до другої дози) становила 80 %.
Станом на квітень 2021 року тривалість захисту від вакцини була невідомою, і для визначення тривалості захисту тривало подальше дворічне дослідження.
Наприкінці жовтня оприлюднено дані, що за деякий час після вакцинації, насамперед, слабшає античний імунітет (якщо перші три місяці курс щеплень захищає імунітет, умовно кажучи, на 92%, то за півроку дієвість буде 81%). Водночас, дія Т-лімфоцитів або лімфоцитів пам'яті, які відіграють центральну роль в інактивації вірусу, зберігається роками.
За словами директора Інституту біохімії НАН України Сергій Комісаренка, термін захисту вакцин може відрізнятися також, залежно від препарату, що використовується. Наприклад, від Moderna імунітет триває довше, ніж, наприклад, від вакцини Pfizer.
"Чому це відбувається – вченим невідомо. Одна з причин може полягати в тому, що коли колють Moderna – вводять 100 мікрограмів мРНК, а коли Pfizer - 30 мікрограмів. Тому, можливо, імунна пам'ять у першому випадку довша", – додав академік.
Дієвість
| Варіант | Дві дози | Одна доза | ||
|---|---|---|---|---|
| Симптоматика | Госпіталізація | Симптоматика | Госпіталізація | |
| Інші циркулюючі раніше | 6999930000000000000♠93% (7001870000000000000♠87–6999960000000000000♠96%) | 6999900000000000000♠90% (7001800000000000000♠80–7000100000000000000♠100%) | 6999610000000000000♠61% (7001530000000000000♠53–6999670000000000000♠67%) | 6999760000000000000♠76% (7001460000000000000♠46–6999900000000000000♠90%) |
| Альфа | 6999900000000000000♠90% (7001850000000000000♠85–6999940000000000000♠94%) | 6999940000000000000♠94% (7001590000000000000♠59–6999990000000000000♠99%) | 6999610000000000000♠61% (7001560000000000000♠56–6999660000000000000♠66%) | 6999590000000000000♠59% (7001390000000000000♠39–6999730000000000000♠73%) |
| Бета | 6999880000000000000♠88% (7001610000000000000♠61–6999960000000000000♠96%) | 7000100000000000000♠100% | 6999430000000000000♠43% (7001220000000000000♠22–6999590000000000000♠59%) | 6999560000000000000♠56% (2999100000000000000♠−9 to 6999820000000000000♠82%) |
| Гамма | ||||
| Дельта | Не повідомляється | Не повідомляється | Не повідомляється | Не повідомляється |
Конкретні групи населення
Наявні обмежені дані щодо безпеки вакцини Moderna проти COVID-19 для вагітних. Початкове дослідження виключило вагітних жінок або було припинено їхню вакцинацію після позитивного тесту на вагітність. Дослідження на тваринах не виявили проблем з безпекою, і зараз проводяться клінічні випробування щодо оцінки безпеки та ефективності вакцин проти COVID-19 у вагітних. Реальні спостереження за допомогою програми відстеження CDC v-safe не виявили незвичайної кількості несприятливих випадків або результатів, що становлять інтерес. На підставі результатів попереднього дослідження, Центри з контролю та профілактики захворювань у США рекомендували вагітним вакцинуватися вакциною проти COVID-19.
Побічні ефекти
Всесвітня організація охорони здоров'я (ВООЗ) заявила, що «дані безпеки підтверджують сприятливий профіль безпеки» і що профіль побічних реакцій вакцини «не передбачає жодних особливих проблем безпеки». Найбільш поширеними побічними реакціями були біль у місці ін'єкції, втома, головний біль, міалгія (біль у м'язах) та артралгія (біль у суглобах).
Центри з контролю та профілактики захворювань у США (CDC) повідомляли про анафілаксію (важку алергічну реакцію) у 2,5 випадків на мільйон введених доз і рекомендували 15-хвилинний період спостереження після ін'єкції. Уповільнені шкірні реакції в місцях ін'єкцій, що спричиняють еритему, подібну до висипу, також спостерігалися в рідкісних випадках, але вони не вважаються серйозними чи протипоказаннями для подальшої вакцинації. Частота локальної несприятливої еритеми становить близько 10,8 %, у 1,9 % випадків почервоніння може поширюватися до розміру 100 мм або більше.
23 червня 2021 року Центри з контролю та профілактики захворювань у США підтвердили, що міокардит або перикардит зустрічається приблизно у 13 з 1 мільйона молодих людей, переважно чоловіків старших 16 років, які отримали вакцину Moderna або Pfizer-BioNTech. Більшість постраждалих швидко одужують при адекватному лікуванні та відпочинку.
Фармакологія
Технологія Moderna використовує сполуку з модифікованої нуклеозидами матричної рибонуклеїнової кислоти (модРНК) під кодовою назвою mRNA-1273. Як тільки сполука потрапляє всередину клітини людини, мРНК зв'язується з ендоплазматичним ретикулумом клітини. mRNA-1273 кодується, щоби викликати у клітин вироблення специфічного білка, використовуючи звичайний процес виробництва клітини. Вакцина кодує версію спайкового білка з модифікацією під назвою 2P, в якій білок спричинює дві стабілізуючі мутації, в яких вихідні амінокислоти замінені пролінами, розробленими дослідниками з Техаського університету в Остіні та Центру досліджень вакцини Дейла та Бетті БамперсНаціонального інституту алергії та інфекційних захворювань.
Після того, як білок витісняється з клітини, він з часом виявляється імунною системою, яка починає виробляти ефективні антитіла. Система доправлення лікарських засобів mRNA-1273 використовує систему ПЕГілювання ліпосомної доставки наночастинок (LNP).
Склад
Вакцина містить такі інгредієнти:
Активний інгредієнт — це послідовність мРНК, що містить загалом 4101 нуклеотидів, що кодує повнорозмірний глікопротеїн пепломеру SARS-CoV-2 (S) з двома мутаціями (K986P та V987P), призначеними для стабілізації конформації перед злиттям.
Послідовність мРНК додатково поліпшена такими чином:
- усі уридини (U), заміщені N1-метилпсевдоуридином (U → m1Ψ),
- послідовність оточена додатковими 5'-нетрансльованою послідовністю (UTR) та 3'-UTR, взятої з гена альфа-глобіну людини (HBA1),
- введення двох додаткових стоп-кодонів,
- полі-(А)-хвіст на 3'-кінці.
Передбачувана послідовність мРНК-вакцини була опублікована на форумі для професійних вірусологів, отримана шляхом прямого секвенування залишкового матеріалу вакцини у використаних флаконах.
мРНК вакцини розчиняють у водному буфері, що містить трометамін, гідрохлорид трометаміну, натрій ацетат та сахарозу. мРНК інкапсульована в наночастинках ліпідів, які стабілізують мРНК і полегшують її надходження в клітини. Наночастинки виробляються з таких ліпідів:
- 1,2-дистеароїл-сн-гліцеро-3-фосфохолін (DSPC),
- холестерол,
- PEG2000-DMG (поліетиленгліколь (PEG) 2000-диміристоїлгліцерин (DMG)), та
- SM-102
Виробництво
У червні 2020 року Moderna уклала контракт з Catalent, відповідно до якого Catalent наповнюватиме та пакуватиме флакони із кандидатом на вакцину. Catalent також забезпечить зберігання та розповсюдження.
9 липня 2020 року Moderna повідомила про угоду про незавершене виробництво з Laboratorios Farmacéuticos Rovi у разі схвалення вакцини.
Moderna значною мірою покладається на організації контрактного виробництва, для розширення процесу виробництва вакцин. Першим кроком процесу — синтезом ДНК-плазмід (який буде використовуватися як шаблон для синтезу мРНК) — переймався підрядник під назвою Aldevron із Фарго, штат Північна Дакота, США. Для решти процесу Moderna уклала договір з компанією Lonza Group щодо виробництва вакцини на підприємствах у Портсмуті, штат Нью-Гемпшир, США та у Фісп у Швейцарії, та закупівлі необхідних допоміжних речовин ліпідів у компанії CordenPharma. Крім організацій контрактного виробництва, Moderna також виробляє вакцину на власному виробничому підприємстві в Норвуді, штат Массачусетс, США.
Для виконання завдань з наповнення та пакування флаконів (заповнення та завершення) Moderna уклала контракти з Catalent у США та Laboratorios Farmacéuticos Rovi в Іспанії. У квітні 2021 року Moderna розширила угоду з Catalent щодо збільшення обсягів виробництва на заводі останньої в Блумінгтоні, штат Індіана, США. Розширення дозволить Catalent виробляти до 400 флаконів на хвилину та заповнювати ще 80 мільйонів флаконів на рік. Пізніше цього ж місяця, Moderna оголосила про свої плани витратити мільярди доларів на збільшення виробництва вакцин, потенційно потроївши обсяги виробництва у 2022 році, стверджуючи також, що в 2021 році вона виробить не менше 800 мільйонів доз. Збільшення виробництва частково пояснюється удосконаленням компанією методів виробництва.
Результати дослідження вакцини, розробленої Moderna, пішли за попередніми підсумками дослідження кандидата на вакцину Pfizer-BioNTech BNT162b2, причому Moderna демонструє подібну ефективність, але вимагає зберігання за температури стандартного медичного холодильника 2–8 °C до 30 днів або -20 °C протягом чотирьох місяців, тоді як кандидат Pfizer-BioNTech вимагає зберігання в ультрахолодних морозильних камерах при температурі між -80 і -60 °C. Країни з низьким рівнем доходу зазвичай мають холодові ланцюги для зберігання лише у стандартних холодильниках, а не в ультрахолодних морозильних камерах. У лютому 2021 року обмеження щодо вакцини Pfizer були послаблені, коли Управління з продовольства і медикаментів США (FDA) оновило дозвіл на екстрене використання (EUA), щоб дозволити транспортувати та зберігати нерозбавлені заморожені флакони вакцини при температурі між -25 та -15 °C протягом двох тижнів перед використанням.
У листопаді 2020 року Nature повідомив, що «Хоча відмінності у складах LNP або вторинних структурах мРНК можуть пояснювати відмінності в термостабільності [між Moderna та BioNtech], багато експертів підозрюють, що обидва вакцинні продукти в кінцевому підсумку зупиняться на однакових вимогах щодо зберігання за різних температурних умов та термінів зберігання».
Історія
У січні 2020 року Moderna оголосила про розробку РНК-вакцини, під назвою mRNA-1273, для індукування імунітету до SARS-CoV-2.
Moderna отримала 955 мільйонів доларів від Управління з удосконалення біомедичних досліджень США, офісу Міністерства охорони здоров'я і соціальних служб США. Управління з удосконалення біомедичних досліджень США профінансувало 100 % вартості отримання ліцензії від Управління з продовольства і медикаментів США.
Уряд Сполучених Штатів виділив 2,5 мільярда доларів США загального фінансування на вакцину Moderna проти COVID-19 (mRNA-1273). Приватні донори також внесли внесок у розробку вакцини.
Клінічні випробування
Фаза I—II
У квітні 2020 року у партнерстві з Національним інститутом алергії та інфекційних захворювань США розпочалася I фаза клінічних випробування на людях вакцини mRNA-1273. У квітні Управлінням з удосконалення біомедичних досліджень США (BARDA) виділило до 483 мільйонів доларів на розробку вакцини Moderna. Плани щодо випробування дозування та ефективності під час II фази клінічних виробувань, яке розпочнеться у травні, були схвалені Управліннямз продовольства і медикаментів США (FDA). Moderna уклала угоду про партнерство зі швейцарським виробником вакцин Lonza Group, з метою постачання 300 мільйонів доз вакцини на рік.
25 травня 2020 року Moderna розпочала фазу IIa клінічного дослідження, до якої було залучено 600 дорослих учасників для оцінки безпеки та відмінностей у відповіді антитіл на дві дози кандидата на вакцину mRNA-1273, яке планується завершити в 2021 році.
14 липня 2020 року вчені Moderna опублікували попередні результати I фази клінічного випробування підвищення дози mRNA-1273, що демонструє дозозалежну індукцію нейтралізуючих антитіл проти S1/S2 вже через 15 днів після ін'єкції. Помірний та небажаний вплив, такий як гарячка, втома, головний біль, міалгія та біль у місці ін'єкції, спостерігались у всіх групах дозування, але часто спостерігались при збільшенні дозування. Вакцина в низьких дозах була визнана безпечною та ефективною для допуску до III фази клінічного випробування із застосуванням двох доз по 100 мкг, які вводяться з інтервалом 29 днів.
У липні 2020 року Moderna повідомила у попередньому звіті в рамках державно-приватного партнерства Operation Warp Speed, що кандидат на вакцину призвів до вироблення організмом нейтралізуючих антитіл у здорових дорослих на І фазі клінічного дослідження. «При дозуванні у 100 мікрограмів, яку „Moderna“ просуває до більш масштабних досліджень, усі 15 пацієнтів відчували побічні ефекти, включаючи втому, озноб, головний біль, біль у м'язах та біль у місці ін'єкції». Проблемні збільшені дози були виключені в липні з майбутніх досліджень.
Фаза III
Moderna та Національний інститут алергії та інфекційних захворювань 27 липня розпочали III фазу клінічних досліджень в США, плануючи зарахувати та розподілити 30 000 добровольців до двох груп — одна група отримувала дві дози вакцини mRNA-1273 по 100 мкг, а інша отримувала плацебо 0,9 % хлориду натрію. Станом на 7 серпня зареєструвалось понад 4 500 добровольців.
У вересні 2020 року Moderna опублікувала детальний план вивчення результатів клінічного дослідження. 30 вересня генеральний директор Стефан Бансель заявив, що, якщо дослідження будуть успішними, вакцина може бути доступна для суспільства вже наприкінці березня або на початку квітня 2021 року. Станом на жовтень 2020 року Moderna завершила реєстрацію 30 000 учасників, необхідних для проведення III фази клінічних досліджень. Національний інститут охорони здоров'я США оголосив 15 листопада 2020 року, що загальні результати досліджень були позитивними.
Станом на лютий 2021 року, проміжний аналіз III фази клінічного дослідження вказує на ефективність на рівні 94 % у запобіганні зараженню COVID-19.Побічні ефекти включали грипоподібні симптоми, такі як біль у місці ін'єкції, втома, біль у м'язах та головний біль. Клінічне випробування триває і має завершитися наприкінці 2022 року.
Із вересня 2020 року компанія Moderna використовує тест Elecsys Anti-SARS-CoV-2 S компанії Roche Diagnostics, схвалений Управлінням з продовольства і медикаментів США (FDA) згідно з дозволом на екстрене використання (EUA) 25 листопада 2020 року. За словами незалежного постачальника клінічних аналізів у мікробіології, «це полегшить кількісне вимірювання антитіл до SARS-CoV-2 та допоможе встановити кореляцію між індукованим захистом вакцини та рівнем антитіл до рецепторів зв'язування (RBD)». Про партнерство Roche повідомила 9 грудня 2020 року.
Огляд Управління з продовольства і медикаментів США у грудні 2020 року проміжних результатів клінічних випробувань III фази mRNA-1273 показав, що вакцина є безпечною та ефективною проти інфекції COVID-19, що стало підставою до видачі дозволу на екстрене використання у США.
Ліцензування
Прискорене
Станом на грудень 2020 року mRNA-1273 перебувала на етапі оцінки для отримання дозволу на екстрене використання (EUA) у багатьох країнах, що дозволило б швидко розповсюдити вакцину у Великій Британії, Європейському Союзі, Канаді та США.
18 грудня 2020 року mRNA-1273 була дозволена Управлінням з продовольства і медикаментів США (FDA) для екстреного використання. This is the first product from Moderna that has been authorized by the FDA.
23 грудня 2020 року mRNA-1273 була дозволена Департаментом здоров'я Канади.
5 січня 2021 року Міністерство здоров’я дозволило використовувати mRNA-1273 в Ізраїлі.
3 лютого 2021 року Управління медичних наук дозволив використання mRNA-1273 у Сінгапурі.
30 квітня 2021 року Всесвітня організація охорони здоров'я (ВООЗ) затвердила список екстрених випадків для використання вакцини Moderna.
5 травня 2021 року Управління з продовольства і медикаментів Філіппін дозволила mRNA-1273 для екстреного використання на Філіппінах.
21 травня 2021 року внутрішньом'язову вакцину Moderna проти COVID-19 (раніше TAK-919) було дозволено для екстреного використання в Японії.
29 червня 2021 року Генеральний контролер з препаратів Індії дозволив використання mRNA-1273 в Індії. Того ж дня вакцина також була схвалена Міністерством охорони здоров’я В’єтнаму для екстреного застосування в країні.
5 серпня 2021 року Національне агентство з регулювання фармацевтичної діяльності Малайзії (NPRA) надало умовну реєстрацію для екстреного використання вакцини в країні.
Звичайне
6 січня 2021 року Європейське агентство з лікарських засобів (EMA) рекомендувало надати умовний дозвіл на продаж, і рекомендація була прийнята Європейською комісією того ж дня. 6 червня 2021 року EMA розпочала оцінку заявки на розширене застосування вакцини Moderna проти COVID-19 для людей віком від 12 до 17 років.
12 січня 2021 року Швейцарське агентство з лікувальних товарів видало тимчасовий дозвіл на мРНК-вакцину Moderna у Швейцарії.
1 квітня 2021 року Агентство з регулювання лікарських засобів та медичних товарів видало повний дозвіл на продаж вакцини у Сполученому Королівстві.
Подальші дослідження
Залишається невідомим, чи вакцина Moderna проти COVID-19 забезпечує довічний імунітет, чи потрібні періодичні ревакцинації. Вагітні та жінки, що годують груддю, також були виключені з перших випробувань, які використовувалися для отримання дозволу на екстрене використання, хоча очікується, що випробування у цих групах населення будуть проведені у 2021 році.
У січні 2021 року Moderna оголосила, що запропонує третю дозу вакцини людям, які були щеплені двічі на етапі I фази клінічних досліджень. Додаткова доза буде доступна учасникам через шість-дванадцять місяців після того, як вони отримали другу дозу. Компанія заявила, що може також вивчити третю ін'єкцію в учасників III фази випробування, для підтвердження даних про стійкість антитіл.
У 2020 році Moderna співпрацювала з фармацевтичною компанією Takeda Pharmaceutical Company та Міністерством охорони здоров'я, праці й добробуту Японії (MHLW). У Японії вакцина відома як «Внутрішньом'язова вакцина Moderna проти COVID-19» (англ. COVID-19 Vaccine Moderna Intramuscular Injection).
25 січня 2021 року Moderna розпочала розробку нової форми вакцини, яка отримала назву mRNA-1273.351, яка могла б бути використана як додаткова ін'єкція проти бета-варіанту SARS-CoV-2 (лінія поколінь В.1.351). Вона також розпочала тестування, щоби побачити, чи можна використати третю ін'єкцію наявної вакцини для протидії різним варіантам вірусу. 24 лютого Moderna оголосила, що виготовила та відправила достатню кількість mRNA-1273.351 до Національного інституту охорони здоров'я США для проведення І фази клінічних випробувань. 16 березня 2021 року, щоби збільшити кількість вакцинованих, Moderna розпочала клінічні випробування вакцини для дітей віком від 6 місяців до 11 років у США та Канаді (KidCove), на додаток до існуючого та повність схваленого дослідження вакцини, для дітей віком 12-17 років (TeenCOVE).
Moderna випробовує дослідницькі додаткові ін'єкції mRNA-1273.351 та mRNA-1273.211.
У січні 2022 року компанія Moderna оголосила про створення комбінованої вакцини, яка захищатиме одночасно від грипу та від COVID-19, завершити її створення можуть до осені 2023 року.
Суспільство та культура
Торгові марки
mRNA-1273 була кодовою назвою під час розробки та тестування, elasomeran — запропонована міжнародна непатентована назва (pINN), а Spikevax — торгова марка.
Економіка
У червні 2020 року Сінгапур підписав угоду про попередню закупівлю з компанією Moderna, за якою, як повідомляється, країна сплачує високу ціну, щоб забезпечити достроковий запас вакцини, хоча уряд відмовився надавати фактичну ціну та кількість, посилаючись на комерційну чутливість та положення про конфіденційність.
11 серпня 2020 року уряд США уклав угоду про закупівлю 100 мільйонів доз очікуваної вакцини Moderna, яку, як пише Financial Times, Moderna планувала оцінити від 50 до 60 доларів США за курс вакцинації. У листопаді 2020 року Moderna заявила, що буде стягувати з урядів, які купують її вакцину, від 25 до 37 доларів США за дозу, тоді як ЄС шукає вакцину ціною менше 25 доларів США за дозу за 160 мільйонів доз, які вона планує придбати у Moderna.
У 2020 році Moderna також уклала угоди про постачання mRNA-1273 з Європейським Союзом на 160 мільйонів доз та з Канадою на 56 мільйонів доз. 17 грудня у твіті державного секретаря з питань бюджету Бельгії було сказано, що ЄС заплатить 18 доларів США за дозу, тоді як Нью-Йорк таймс повідомив, що США заплатять 15 доларів США за дозу.
Зважаючи на схвалення вакцини 23 грудня 2020 року у Канаді, прем'єр-міністр Канади Джастін Трюдо раніше заявив, що постачання почнуться протягом 48 годин після схвалення, а до кінця грудня буде поставлено 168 000 доз.
17 лютого 2021 року перша партія прибула до Сінгапуру.
У лютому 2021 року Moderna заявила, що очікує на продаж вакцини проти COVID-19 на 18,4 млрд доларів.
Суперечки
7 липня стало відомо про суперечки між Moderna та державними вченими щодо небажання компанії ділитися даними клінічних досліджень.
Moderna також зіткнулася з критикою за те, що їй не вдалося залучити кольорових людей до клінічних випробувань.
Патентна тяганина
Система ПЕГілювання ліпосомної доставки наночастинок (LNP) mRNA-1273 була предметом постійного судового спору з Arbutus Biopharma, від якого Moderna раніше хотіла отримати ліцензію на технологію LNP. 4 вересня 2020 року Nature Biotechnology повідомив, що Moderna програла ключовий спір у цій справі.
Участь в COVAX
Бере участь в COVAX — глобальна ініціатива, спрямована на рівний доступ до вакцин проти COVID-19.
В Україні
Україна отримала 2 000 040 доз вакцини Moderna проти COVID-19 від уряду США через глобальну ініціативу COVAX.
Див. також
- Комірнаті, вакцина Pfizer/BioNTech
- AZD1222, вакцина AstraZeneca
- mRNA-1283, інша вакцина компанії Moderna
Виноски
Посилання
- VRBPAC mRNA-1273 Sponsor Briefing Document (PDF). Moderna. 17 грудня 2020. Архів оригіналу за 13 травня 2021. Процитовано 12 січня 2021.
- How Moderna's Covid-19 Vaccine Works. Нью-Йорк таймс. Архів оригіналу за 7 травня 2021. Процитовано 12 січня 2021.