Ізотопи оксигену
|
Поширеність ізотопів кисню | |
|---|---|
| 16O | 99.76% |
| 17O | 0.04% |
| 18O | 0.20% |
Ізото́пи ки́сню — атоми кисню (оксигену) з різною чисельністю нейтронів у ядрах. Відомо 18 ізотопів кисню, з них три — стабільних: 16O, 17O, 18O. Решта 15 — від 11O до 28O —— радіоактивні та мають період напіврозпаду менше 123 секунд.
Кисень-16 є третім за поширеністю ізотопом у Всесвіті, поступається лише 1H та 4He. На Землі частка 16O з-поміж ізотопів кисню становить 99,76%, внаслідок цього атомна маса кисню усереднено становить 7001159994000000000♠15.9994 а.о.м.. В окремих середовищах, внаслідок температурних змін, тощо вона коливається в проміжку 7001159990300000000♠15.99903—7001159997700000000♠15.99977 а.о.м..
Зміст
Стабільні ізотопи
У природі існує три стабільних ізотопи кисню: 16O, 17O, 18O.
Кисень-16 є другим після гелію-4 найрозповсюдженішим ізотопом з поміж продуктів зоряного нуклеосинтезу. Та утворюється після потрійної альфа реакції:
4He + 4He → 8Be (−0.0918 MeV) Злиттям двох ядер гелію-4 виникає нестабільний берилій-8. 8Be + 4He → 12C + 2 γ||(+7.367 MeV)|| Якщо берилій-8 встигає провзаємодіяти з ядром гелію-4, утворюється вуглець-12. 12C + 4He → 16O + γ ||(+7.162 MeV)|| вуглець-12 поглинанням ядра гелію-4 у свою чергу продукує кисень-16.
У свою чергу два ядра кисню-16, в надрах масивних зір при температурах від 7009150000000000000♠1500000000 K, можуть зливатися в ядра важчих елементів. Внаслідок цієї реакції ядерного горіння кисню утворюються різноманітні ізотопи, як масивніші (24Mg, 27Al, 28Si, 30P, 31P, 30S, 31S, 32S) так і легші (1H, 2H, 4He).
Співвідношення ізотопів
1935 року було виявлено, що співвідношення R= 18O16O в атмосфері Землі є вищим аніж у морській воді. Явище отримало назву ефект Доула на честь американського хіміка. Станом на 2005 рік співвідношення δ було виміряне: R(атмосфери)R(океану)-1=23.88‰. Цей дисбаланс виникає через мас-залежне фракціонування ізотопів хімічних елементів живими організмами (при диханні чи фотосинтезі). Також важка вода (молекули з важчими ізотопами кисню чи водню) слабше випаровується з водойм при нижчих температурах. Аналізуючи співвідношення δ= R(зразок)R(стандарт)-1 можна оцінити температуру клімату планети на момент формування зразка, наприклад, вмерзання повітряної бульбашки в кригу. Порівняння ізотопного складу кисню для вкраплень повітря в крижаних кернах льодовиків із сучасними значеннями (наприклад Віденський стандарт середньої океанічної води) дозволяє палеоекології встановлювати хронологію кліматичних змін.
Радіонукліди
Окрім трьох стабільних ізотопів кисню, було штучно синтезовано ще 15, усі вони короткоживучі. Найдовше існує 15O — період напіврозпаду 7002122240000000000♠122.24±0.16 c. Найкоротше 25O — 7000279999999999999♠2.8±0.5. × 10-21 с.
- Ізотопи з меншою кількістю нейронів (11O—15O) головно за рахунок бета-розпаду з випромінюванням позитрона (β+) перетворюються на вуглець чи азот.
- Ізотопи з більшою кількістю нейронів (19O—28O) зазвичай через бета-розпад з випускання електрона (β-), перетворюються на флуор.
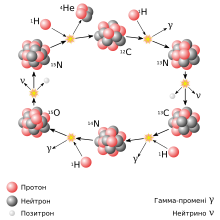
Кисень-15
Кисень-15 є однією з проміжних ланок вуглецево-азотного циклу (CNO-циклу), в якому чотири ядра протію (1H) перетворюються на ядро гелію-4 (4He). Цикл відіграє важливу роль в зоряному нуклеосинтезі.
Цей радіонуклід застосовується в медицині для позитронно-емісійної томографії (PET-візуалізація). 15O розпадається, випромінюючи позитрон, який у свою чергу анігілює з електроном з емісією двох гамма-квантів (з енергіями по ~511 кеВ). Аналіз розподілу гамма-квантів і використовується при обстеженні легень, центральної та периферійної гемодинаміки тощо. Щоправда через короткий час існування (період напіврозпаду — близько 2 хвилин), частіше застосовують інші ізотопи (11C, 13N, 18F).
В умовах земної атмосфери кисень-15 утворюється зокрема внаслідок впливу гамма-променів, що виникають зокрема від блискавок, на стабільний ізотоп 16O в молекулах кисню O2.
Упродовж кількох хвилин після утворення майже весь кисень-15 перетворюється на стабільний азот-15:
15O → 15N +
ν +
e+
Гамма-промені, що утворюються внаслідок анігіляції позитрона, пролітають в середньому до 90 м в атмосфері.
Список ізотопів кисню
| Символ нукліду |
Z(p) | N(n) | Маса ізотопу (а.од.м.) |
Період напіврозпаду (T1/2) |
Канал розпаду (ймовірність) |
Похідні ізотопи |
Спін і Парність ядра |
|---|---|---|---|---|---|---|---|
| Енергія збудження | |||||||
| 11O | 8 | 3 | 7001110000000000000♠11.0(1) | [~3.4 MeV] | 2p | 9C | 3/2−, 5/2+ |
| 12O | 8 | 4 | 7001120342620000000♠12.034262(26) | > 6.3× 10-21 c | 2p (60%) p (40%) |
10C 11N |
0+ |
| 13O | 8 | 5 | 7001130248150000000♠13.024815(10) | 8.58(5)× 10-3 c | β+ (89.1%) β+p (10.9%) |
13N 12C* |
(3/2−) |
| 14O | 8 | 6 | 7001140085967060000♠14.008596706(27) | 70.621(14) c | β+ | 14N* | 0+ |
| 15O | 8 | 7 | 7001150030656000000♠15.0030656(5) | 122.24(16) с | β+ | 15N* | 1/2− |
| 16O* | 8 | 8 | 7001159949146196000♠15.99491461960(17) | стабільний | — | — | 0+ |
| 17O* | 8 | 9 | 7001169991317566000♠16.9991317566(7) | стабільний | — | — | 5/2+ |
| 18O* | 8 | 10 | 7001179991596128000♠17.9991596128(8) | стабільний | — | — | 0+ |
| 19O | 8 | 11 | 7001190035780000000♠19.0035780(28) | 26.464(9) с | β− | 19F* | 5/2+ |
| 20O | 8 | 12 | 7001200040754000000♠20.0040754(9) | 13.51(5) с | β− | 20F | 0+ |
| 21O | 8 | 13 | 7001210086550000000♠21.008655(13) | 3.42(10) с | β− | 21F | (5/2+) |
| 22O | 8 | 14 | 7001220099700000000♠22.00997(6) | 2.25(9) с | β− (78%) β−n (22%) |
22F 21F |
0+ |
| 23O | 8 | 15 | 7001230157000000000♠23.01570(13) | 9.7(8)× 10-2 c | β− (93%) β−n (7%) |
23F 22F |
1/2+ |
| 24O | 8 | 16 | 7001240198600000000♠24.01986(18) | 6.5(5)× 10-2 c | β− (57%) β−n (43%) |
24F 23F |
0+ |
| 25O | 8 | 17 | 7001250293400000000♠25.02934(18) | 2.8(5)× 10-21 c | n | 24O | 3/2+# |
| 26O | 8 | 18 | 7001260372100000000♠26.03721(18) | 9.0× 10-21 c | 2n | 24O | 0+ |
| 27O | 8 | 19 | 7001270477200000000♠27.04772(54) | <2.6× 10-7 c | n (?) 2n (?) |
? | 3/2+# |
| 28O | 8 | 20 | 7001280559100000000♠28.05591(75) | <1.00× 10-7 c | n (?) 2n (?) |
? | 0+ |
|
() — ± щодо останніх вказаних порядків значень; * — стабільні ізотопи;? — невідомо; # — розрахункові дані; (β) — бета-розпад (β− — електрон; β+ — позитрон); p — протонний розпад ; n — випромінювання нейтрона; | |||||||
Дивись також
Джерела
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||||||