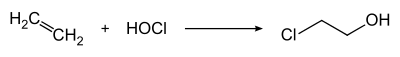Гіпохлоритна кислота
| Гіпохлоритна кислота | |
|---|---|

| |

| |
| Інші назви | Хлорноватиста кислота |
| Ідентифікатори | |
| Номер CAS | 7790-92-3 |
| Номер EINECS | 232-232-5 |
| DrugBank | 14135 |
| Назва MeSH | D01.029.260.365, D01.210.465, D01.339.431.311 і D01.650.550.400 |
| ChEBI | 24757 |
| SMILES | OCl |
| InChI | InChI=1S/ClHO/c1-2/h2H |
| Номер Гмеліна | 688 |
| Властивості | |
| Молекулярна формула | HClO |
| Молярна маса | 52,460 г/моль |
| Зовнішній вигляд | безбарвна або з жовтувато-зеленим відтінком (лише у розчині) |
| Кислотність (pKa) | 7,40 |
| Термохімія | |
|
Ст. ентальпія утворення ΔfH 298 |
-120,9 кДж/моль |
| Пов'язані речовини | |
| Інші аніони | хлоридна кислота |
| Інші катіони | гіпохлорит натрію, гіпохлорит кальцію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Гі́похлори́тна кислота́ — слабка кислота складу HClO, яка утворює ряд солей гіпохлоритів. Є дуже нестійкою сполукою і може існувати тільки в розведеному (до 30%) розчині, в якому також продовжує розкладатися, особливо під впливом сонячного світла. Сполука проявляє сильні окисні властивості.
Застосовується для знезараження води та, рідше, як відбілювач і окисник.
Зміст
Фізичні властивості
Гіпохлоритна кислоту не вдалося виділити як окрему речовину через її нестійкість, вона існує лише у вигляді розчинів. Максимальна концентрація в розчині досягає 30% (але тільки при температурах нижче -20 °C). Водні розчини є безбарвними або з жовтувато-зеленим відтінком при більших концентраціях. Може екстрагуватися в етери.
Отримання
Гіпохлоритну кислоту синтезують пропусканням хлору крізь воду. В результаті хлор диспропорціонує з утворенням гіпохлоритної та хлоридної кислот:
Дана реакція є частково зворотньою. Домогтися зміщення рівноваги в бік продуктів можна додаванням до реакційної суміші оксиду ртуті(II), який зв'язує хлорид-іони:
Таким чином отримують достатньо концентровані розчини HClO. Замість оксиду HgO можна використовувати більш доступний та безпечний гідрокарбонат кальцію:
Також синтезують гіпохлоритну кислоту пропусканням суміші вологого хлору та повітря крізь колону з HgO, і подальшим розчиненням утвореного оксиду хлору Cl2O у воді при кімнатній температурі:
Хімічні властивості
Гіпохлоритна кислота є вельми нестійкою сполукою і повільно розкладається; освітлення пришвидшує процес розкладання:
-
(на світлі або вище 20 °C)
-
(на світлі)
Утворений атомарний кисень окиснює гіпохлоритнк кислоту до хлоратної:
-
(на світлі)
Кислота активно розкладається при нагріванні:
Насичений розчин кислоти за відсутності світла може дегідратуватися з утворенням рідкого оксиду Cl2O, а взаємодія з хлоридною кислотою веде до утворення хлору:
-
(без світла)
HClO проявляє слабкі кислотні властивості, реагує з лугами та гідроксидом амонію. Утворені солі гіпохлоритної кислоти називають гіпохлоритами:
Гіпохлоритна кислота є одним з найсильніших окисників.
Завдяки високій окисній здатності, HClO (у вигляді водних розчинів хлору) застосовується в органічному синтезі для добування хлоропохідних. Наприклад, реакцією етену з гіпохлоритною кислотою синтезують етиленхлоргідрин (2-хлороетанол), який є прекурсором для отримання оксирану:
Також із хлорогідринів, через стадію утворення нітрилів, синтезують β-гідроксикислоти:
Токсичність
Гіпохлоритна кислота є токсичною речовиною, що подразнює шкіру та дихальні шляхи. Концентровані розчини HClO можуть завдавати сильних опіків.
Застосування
Через свою низьку стійкість гіпохлоритна кислота не має широкого використання. Основною сферою застосування кислоти є знезараження води (питної, у басейнах). Подеколи використовується у складі відбілюючих сумішей.
Див. також
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5.
- Vogt H. Chlorine Oxides and Chlorine Oxygen Acids // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 4—5. — DOI:10.1002/14356007.a06_483.pub2.
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1963. — Т. 1. — 922 с.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Химический энциклопедический словарь / И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с.
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.