
Етанол
- Алкоголь перенаправляє сюди. Інше поширене значення терміну — Алкогольні напої. Для інших значень див. Алкоголь (значення)
| Етанол | |
|---|---|
 просторова будова
| |
|
скелетна структура
|
|
| Назва за IUPAC | етанол |
| Інші назви | етиловий спирт, етилгідроксид |
| Ідентифікатори | |
| Номер CAS | 64-17-5 |
| Номер EINECS | 200-578-6 |
| Номер EC | 200-578-6 |
| DrugBank | 00898 |
| KEGG | D06542, D00068 і C00469 |
| Назва MeSH | D02.033.375 |
| ChEBI | 16236 |
| RTECS | KQ6300000 |
| Код ATC | V03AZ01, V03AB16 і D08AX08 |
| SMILES | CCO |
| InChI |
1S/C2H6O/c1-2-3/h3H,2H2,1H3 Key: LFQSCWFLJHTTHZ-UHFFFAOYSA-N |
| Номер Бельштейна | 1718733 |
| Номер Гмеліна | 787 |
| 3DMet | B01253 |
| Властивості | |
| Молекулярна формула | C2H5OH |
| Молярна маса | 46,068 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Запах | спиртовий |
| Густина | 0,7893 г/см³ (20 °C) |
| Тпл | -114,14 °C |
| Ткип | 78,29 °C |
| Розчинність (вода) | змішується |
| Діелектрична проникність (ε) | 25,3 |
| Показник заломлення (nD) | 1,3611 (20 °C) |
| В'язкість | 1,074 мПа·с |
| Дипольний момент | 1,69 |
| Термохімія | |
|
Ст. ентальпія утворення ΔfH 298 |
-277,6 кДж/моль (рід.) -234,8 кДж/моль (газ) |
|
Ст. ентропія S 298 |
160,7 Дж/(моль·K) (рід.) 81,6 Дж/(моль·K) (газ) |
|
Теплоємність, c p |
112,3 Дж/(моль·K) (рід.) 65,6 Дж/(моль·K) (газ) |
| Небезпеки | |
| ГДК (Україна) | 1000 мг/м³ (у повітрі) |
| Температура спалаху | 13 °C |
| Температура самозаймання | 363 °C |
| Вибухові границі | 3—19% |
| Пов'язані речовини | |
| Пов'язані речовини | етаналь, діетиловий етер, метанол |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Етано́л (ети́ловий спирт, ви́нний спирт) — органічна сполука, представник ряду одноатомних спиртів складу С2Н5ОН (скорочено EtOH). За звичайних умов є безбарвною, легкозаймистою рідиною. Згідно з Національним стандартом України ДСТУ 4221:2003 етанол — це токсична речовина з наркотичною дією, за ступенем впливу на організм людини належить до четвертого класу небезпечних речовин. Має канцерогенні властивості.
Етанол є активною складовою спиртних напоїв, які зазвичай виготовляються ферментацією вуглеводів. Для промислових потреб етиловий спирт часто синтезують з нафтової та газової сировини каталітичною гідратацією етилену. Окрім виготовлення харчових продуктів етанол застосовується у великій кількості як пальне, розчинник, антисептик та сировина для отримання інших промислово важливих речовин.
Зміст
- 1 Хімія
- 2 Історія
- 3 Структура
- 4 Поширення в природі
- 5 Фізичні властивості
- 6 Отримання
- 7 Класифікація етанолу
- 8 Хімічні властивості
- 9 Біологічна дія
- 10 Застосування
- 11 Див. також
- 12 Примітки
- 13 Джерела
- 14 Посилання
Хімія
Етанол змішується з водою у будь-яких пропорціях із виділенням тепла та зменшенням загального об'єму розчину.
У звичайному процесі дистиляції із суміші вода-етанол чистий етанол добути неможливо, а можна отримати лише суміш, що містить до 96 % етанолу за об'ємом.
Якщо вихідна етанолова суміш містила інгредієнти, крім води та етанолу, які неможливо відокремити від етанолу дистиляцією, 96 % етанолу не можна отримати з такої суміші в процесі дистиляції.
96 % дистильована водно-етанолова суміш утворює азеотропну суміш.
96 % чистіший етанол, тобто абсолютний етанол, може бути отриманий шляхом видалення води із суміші вода-етанол ефективніше, ніж звичайна дистиляція, такими методами, як молекулярні сита, завдяки чому із суміші вода-етанол може бути отримано приблизно 99,5 % етанолу. Ще більше води можна видалити, зокрема, шляхом перегонки етанолу з відповідним осушувачем, таким як боргідрид натрію.
Етанол — універсальний розчинник і вихідний матеріал, що використовується для одержання кількох органічних сполук. Етанол є злегка полярною сполукою, тому етанол повністю розчинний у воді, а також інших полярних розчинниках. Вуглеводневий кістяк етанолу, навпаки, дозволяє йому розчинятися в неполярних органічних сполуках. Приклади включають вуглеводні, такі як бензин та дизель.
Суміші етанолу легкозаймисті, а сам етанол горить сажистим, синюватим полум'ям. Отже, етанол є хорошим паливом для двигуна з іскровим запалюванням («бензиновий двигун») і виробляється як біопаливо, серед іншого, з цукрової тростини, залишків їжі, кукурудзи та іншої економічно вигідної вуглеводовмісної сировини.
Суміш етанолу понад 60 % також можна використовувати як дезінфікуючий засіб, оскільки він знищує значну кількість мікроорганізмів.
Історія
Етанол використовувався людством ще з давніх-давен. Він відігравав роль складової частини напоїв, ліків, як заспокійливе та афродизіак, а також мав місце в проведенні релігійних обрядів.
У Стародавньому Єгипті його добували ферментацією рослинної сировини. Таким способом отримували тільки розведений розчин спирту. З метою збільшення концентрації в Китаї винайшли спосіб перегонки. Як свідчать розписи на китайській кераміці, напої з ферментованої суміші рису, фруктів та меду виготовляли ще 9000 років тому. Приблизно в цей же час на Близькому Сході спирт отримували з винограду та ячменю, про що свідчать записи на глиняних табличках в Межиріччі.
Про досліди з випаровуванням та конденсацією води згадував і Арістотель. Але перше повідомлення про існування якогось приладу для дистиляції відноситься лише до 4 сторіччя. Його згадує алхімік Зосіма, який жив в цей час в Александрії і за походженням був чи то єгиптянином, чи то єгипетським греком, а може і євреєм — бо напрочуд добре орієнтувався в юдейській символіці. Зосіма стверджував, що просто перемалював зображення приладу, знайдене ним на стіні одного зі старовинних храмів. Втім, цілком можливо, що таким чином він намагався додати авторитетності своєму повідомленню — бо жодних давньоєгипетських малюнків чогось, що хоча б віддалено нагадувало перегінний куб, до нашого часу не збереглося.
Хімію і медицину на тогочасному Близькому Сході вивчали не лише в Єгипті, а й в Сирії. А згодом, коли офіційна православна церква звинуватила сирійських вчених в єресі, вони знайшли прихисток в сусідній Персії. Тож чимало істориків впевнені, що про принцип дії перегінного куба став відомий і там. За доби Арабського халіфату, який об'єднав під своєю владою і Єгипет, і Сирію, і Персію, про дистиляцію вже говорили як про щось давно відоме й зрозуміле. Її згадували в своїх працях, зокрема, Джабір ібн Хайян (в Європі відомий як Гебер) і Якуб аль-Кінді (Алькінд). Останній залишив докладний опис перегінного куба, який з того часу отримав назву аламбік. З його допомогою аль-Кінді отримував ефірні олії, камфору та «трояндову воду».
Перший опис отримання шляхом дистиляції чистого спирту міститься в «Книзі таємниць» Мухаммада ар-Разі (Разеса), який жив на межі IX і X сторіч. Щоправда, він не стверджував, що є винахідником цього процесу. Першим слово алкоголь вжив Гусейн ібн Сіна (Авіценна). Хоча він називав цим словом не спирт, а порошок сурми.
У XI—XII сторіччях на Заході почали перекладати і вивчати праці мусульманських вчених. А разом з ними отримали східні хімічні та алхімічні технології. Перший із західноєвропейських рецептів отримання спирту належить одному з засновників медичної школи в італійському місті Салерно — Магістру Салернському і був записаний приблизно в 1150 році. XII сторіччям можна датувати також рецепт виготовлення спирту й у збірці «Маппе Клавікула», вочевидь складеної в Єгипті грецькою мовою. Збереглося кілька списків цієї збірки, проте в найдавніших з них рецепту виготовлення спирту немає, а той рецепт, який зберігся, використовувався при обробці тканин.
Першою назвою спирту в рецептах європейських вчених була «аква арденс», тобто «палаюча вода» — вочевидь саме здатність горіти вважалася визначальною для цієї рідини. Але оскільки отримували її з вина, як своєрідну квінтесенцію давнього напою, поширилося й альтернативне ім'я — «спірітус віні», «дух вина». Звідси й походить українське слово «спирт». Італійський алхімік Таддео Альдеротті винайшов в XIII сторіччі подвійну перегонку, завдяки якій отримав 90 % спирт. До того ж він одним з перших європейців запропонував використовувати отриману рідину в медичних цілях. Впевнений в чудодійних властивостях «духу вина», він називав його — «аква віте», тобто «водою життя» або навіть «живою водою».
Чистий етанол вперше отримав у 1796 році російсько-німецький хімік Товій Єгорович Ловіц. Згідно з описом провідного науковця того часу Антуана Лорана Лавуазьє, досліджувана сполука складалася з хімічних елементів вуглецю, водню й кисню. У 1808 році швейцарський біохімік Ніколя Теодор де Соссюр встановив хімічну формулу етанолу, а п'ятдесят років потому шотландський хімік Арчібальд Скотт Купер запропонував його структуру.
Перший синтетичний метод отримання етилену розробили незалежно один від одного англійський хімік Генрі Геннел та французький фармацевт Жорж-Симон Серюлла у 1826 році. А в 1828 році англійський фізик і хімік Майкл Фарадей отримав етанол шляхом каталітичної гідратації етену, побічного продукту переробки нафти і газу. Цей спосіб ліг в основу багатьох методів, котрі застосовуються у виробництві етанолу і донині.
Структура
Обидва атоми вуглецю в молекулі етанолу, зокрема й атом, який зв'язаний з гідроксильною групою, знаходяться у стані sp3-гібридизації. Відстань C—C складає 1,512 ангстрем.
Залежно від положення гідроксильної групи відносно іншої частини молекули, розрізняють гош- (фр. gauche) і транс-форми. Транс-форма характеризується положенням зв'язку O—H гідроксильної групи в одній площині зі зв'язком C—C та одним із C—H зв'язків. У гош-формі атом водню в гідроксильній групі повернутий убік. Дипольний момент для гош-форми складає 1,68 D, а для транс-форми — 1,44 D.
Поширення в природі
Етанол є продуктом життєдіяльності деяких грибів. Серед них основними є роди Saccharomyces, Schizosaccharomyces, а також Kluyveromyces. Одним з найбільш відомих представників цих класів є вид Saccharomyces cerevisiae, котрий має тривіальну назву пивні дріжджі. До інших поширених видів відносяться Saccharomyces pastorianus, Saccharomyces anamensis, Schizosaccharomyces pombe, Candida utilis тощо. Також етанол утворюють деякі бактерії, наприклад, Zymomonas mobilis.
У 1975 році астрономи повідомили про знаходження значних скупчень етанолу в газопиловій хмарі Стрілець B2. За підрахунками науковців кількість наявних там молекул етанолу значно перевищує кількість спирту, отриманого за всю історію людства. Знайдений етанол мав транс-форму молекул, а в 1996 році він був зафіксований і в гош-формі.
Серед можливих шляхів утворення етанолу в міжзоряному середовищі наводиться, зокрема, його синтез із метану та метил-катіону під дією випромінювання:
Іншим потенційним способом є взаємодія метил-катіону із формальдегідом, який також поширений у космосі:
Фізичні властивості
Етанол — безбарвна рідина зі слабким «алкогольним» запахом. Він є летким і легкозаймистим. Змішується в будь-яких пропорціях з водою, етерами, ацетоном, бензеном. Етиловий спирт є гарним розчинником для багатьох органічних, а також неорганічних речовин.
Із водою утворює азеотропну суміш: 95,6 % спирту й 4,4 % води. Безводний етанол незначною мірою гігроскопічний: для досягнення стабільності він здатен поглинути 0,3—0,4 % води.
| −25 °C | 0 °C | 25 °C | 50 °C | 75 °C |
|---|---|---|---|---|
| 3,262 | 1,786 | 1,074 | 0,694 | 0,476 |
Отримання
Гідратація етилену
Для отримання етанолу з етилену є два основні шляхи. Історично першим став метод непрямої гідратації, винайдений у 1930 році компанією «Union Carbide». Інший, розроблений у 1970-х роках, був спроєктований як безкислотний метод (відмова від використання сульфатної кислоти).
Непряма гідратація
Отримання етанолу з етилену із використанням сульфатної кислоти відбувається у три стадії. Спершу етилен поглинається концентрованою кислотою, утворюючи етери етилсульфат або діетил сульфат:
Поглинання проводиться 95—98 % розчином кислоти за температури 80 °C і тиску 1,3—1,5 МПа. Дана взаємодія є екзотермічною, тому стінки реактора повинні мати охолодження. Присутність у розчині кислоти етилсульфату дозволяє суттєво збільшити швидкість поглинання, оскільки розчинність етилену в етилсульфаті значно вища, аніж у чистій кислоті.
На другій стадії отримані продукти реакції зазнають гідролізу та розкладаються із утворенням спирту й кислоти. Проте не виключеною є взаємодія двох базових етерів, яка веде до утворення третього, діетилового:
Після обробки сульфатної кислоти із абсорбованими етил- і діетилсульфатом у достатній кількості води, розчин набуває концентрації близько 50—60 %. Продукти гідролізу направляються на колони для розділення: розведена кислота залишатиметься внизу резервуара, а газувата спиртово-етерна суміш — нагорі. Цільову суміш промивають водою або розведеним розчином гідроксиду натрію, а згодом очищують перегонкою.
Кінцевим етапом є відновлення концентрації розведеної кислоти. Цей етап є одним з найбільш дороговартісних в усьому синтезі. За допомогою системи кислотних випаровувачів вдається підняти концентрацію кислоти до 90 %. Збільшення цього показника до необхідних 98 % проводиться змішуванням із олеумом (концентрації 103 %).
Серйозною проблемою для методу непрямої гідратації є утворення в кислоті вуглецевих речовин, які чинять вагомий вплив на її концентрацію. Використання концентрованої кислоти також спричинює появу корозії на обладнанні, тому деякі частини обладнання виробляються з кремнію, сплавів танталу, свинцю тощо.
Пряма гідратація
Синтез за схемою прямої гідратації проводиться із використанням каталізаторів. Тут існує дві форми взаємодії:
- із твердим або рідким каталізатором контактують газуваті реагенти (газофазний процес);
- із твердим або рідким каталізатором контактують як рідкі, так і газуваті реагенти (змішанофазний процес).
Етанол синтезують переважно за газофазним процесом. Вихідний етилен та воду пропускають над вугільним каталізатором, що насичений ортофосфатною кислотою:
За звичайних температур лише незначна кількість етанолу може перебувати у газовій фазі, а збільшення температури призведе до зменшення його концентрації. Вирівняти рівновагу реакції можна, застосувавши принцип Ле Шательє — Брауна, — збільшивши тиск у реакційній суміші і зменшивши кількість молекул в системі. Оптимальними умовами для проведення взаємодії є темепратура 250—300 °C і тиск 6,1—7,1 МПа.
Продукт реакції може зазнавати міжмолекулярної дегідратації, що веде до утворення діетилового етеру:
У випадку, якщо у вуглеводневій сировині міститься домішка ацетилену, вона гідратується до етаналю:
Присутність етаналю є небажаною, оскільки з нього утворюється кротоновий альдегід, котрий негативно впливає на якість етанолу, навіть у кількості мільйонних часток:
Отримання ферментацією
Добування етанолу шляхом ферментації (бродіння) цукристих речовин є найстарішим. Для його виробництва може застосовуватися будь-який продукт, що містить цукор або речовини, з яких його можна отримати (наприклад, крохмаль). Як цукровмісні продукти використовують фруктовий і тростинний цукор, цукровий буряк, мелясу, а крохмалевмісними є картопля, зерна пшениці, жита, кукурудзи. Також використовується як сировина целюлоза (з відходів сільського господарства, целюлозно-паперової промисловості тощо).
Добування з крохмалю та цукру
Для перетворення крохмалю в цукристі речовини його спочатку піддають гідролізу. З цією метою сировину (розтерту картоплю або борошно) заварюють гарячою водою, аби прискорити набухання крохмалю. Також до сировини додають фермент, під впливом якого відбувається оцукровування крохмалю, тобто перетворення його в глюкозу.
Як фермент використовують діастазу, що міститься у пророслих зернах, або інші амілази грибкового походження.
Друга стадія, яке є аналогічною і для отримання спирту з цукрів, полягає в анаеробному бродінні, тобто перетворенні на спирт і діоксид вуглецю:
Тут реакція відбувається під дією мікроорганізмів: грибів (дріжджів) або бактерій.
| Характеристика | Zymomonas mobilis |
Saccharomyces carlsbergensis |
|---|---|---|
| Час подвоєння кількості, год | 2,51 | 5,64 |
| Виробництво етанолу, г/(г·год) | 5,44 | 0,82 |
| Вихід продукту, г/г | 0,465 | 0,460 |
Серед застосовуваних у процесі дріжджів чинне місце посідають Saccharomyces cerevisiae (так звані пивні дріжджі). При їхньому використання важливе значення мають кислотність середовища й температура — вони впливають на ріст дріжджів, вихід етанолу, формування побічних продуктів і забруднення бактеріями. Зазвичай таке бродіння в промисловому виробництві проводиться за pH 4—6. При значенні pH менше 5 ріст бактерій у середовищі сильно пригнічений; для росту дріжджів Saccharomyces cerevisiae кислотність повинна підтримуватись у проміжку 2,4—8,6 із оптимальним значенням 4,5, а процес бродіння має більшу інтенсивність у діапазоні 3,5—6.
Більшість дріжджів, що використовуються у виробництві етанолу, мають оптимальну температуру для росту близько 39—40 °C, а максимальне значення спостерігається у виду Kluyveromyces marxianus — 49 °C. Оскільки процес бродіння є екзотермічним (з 1 г поглинутою глюкози виділяється 586 Дж тепла), використання дріжджів із вищою оптимальною температурою росту дозволяє заощадити кошти на охолодженні реакційної системи. Важливим моментом є подача незначних кількостей кисню для синтезу дріжджами ненасичених жирних кислот та ергостеролу, котрі сприяють їхньому росту і добрій проникності клітин. За відсутності кисню нестача кислот і стеролу спричинить зміни у фізіології дріжджів вже через кілька поколінь.
Також у синтезі етанолу застосовують бактерії, зокрема, поширений вид Zymomonas mobilis, які мають більшу швидкість росту, вищий вихід кінцевого продукту й не залежать від подачі кисню.
Добування з целюлози
Як целюлоза, так і крохмаль є полісахаридами, полімерами вуглеводів, але синтез етанолу з целюлози значно важчий через її малу схильність до гідролізу. Її структура більш подібна до кристалічної, що ускладнює розрив зв'язків всередині полімеру, а у рослинах її захищає від гідролітичного розпаду шар лігніну (після обробки целюлози кислотою гідролізується лише 15 % усієї маси). У відходах сировини також міститься геміцелюлоза, яка складається переважно з пентоз.
Передопераційна обробка включає в себе розмелювання, замочування вихідної сировини для набухання. Згодом її нагрівають в автоклавах з 0,3—0,5%-ю кислотою під тиском 7—10 атм. Як кислота найчастіше використовується сульфатна, рідше — хлоридна. По закінченні процесу кислоту концентрують в окремому резервуарі і знову пускають у виробництво, а лігнін відфільтровують і очищують промиванням.
Одержаний таким способом етиловий спирт називають гідролізним. Його застосовують лише для технічних цілей, бо в ньому міститься цілий ряд шкідливих домішок, зокрема метиловий спирт, ацетон тощо.
Також, на противагу кислотному гідролізу, застосовується ензиматичний метод. Тут гідроліз відбувається під дією грибів на кшталт Trichoderma viride. Попередня обробка має такі етапи: усування лігнінової оболонки дією розчиннику кадоксену (розчин із 5—7 % вмістом оксиду кадмію та 28 % етилендиаміну) та обробка рідким аміаком під високим тиском, котрий розбурхує волокна у целюлозі, полегшуючи проникнення ензимів. У деяких випадках вдається досягти стовідсоткової переробки целюлози.
Інші способи
Гідроліз галогенопохідних вуглеводнів
Етанол утворюється при гідролізі галогенозаміщеного етану. Його проводять у воді або у водному розчині лугів. У першому випадку реакція є зворотною, а в другому може відбуватися елімінування (відщеплення) гідрогенгалогеніду:
Конверсія синтез-газу
Добування етанолу із синтез-газу є аналогічним до методу отримання метанолу за процесом Фішера — Тропша:
Реакція відбувається за температури 125—175 °C і тиску 1,42 МПа, використовуючи каталізатор на кшталт порошкоподібного заліза.
Відновлення органічних сполук
Відновлення альдегідів та кислот є досить поширеним методом отримання спиртів, в тому числі й етанолу:
Каталітичне відновлення зазвичай проводять над нікелем Ренея, платиною; у лабораторних умовах застосовується алюмогідрид літію та борогідрид натрію.
Очистка етанолу
Синтезований етанол зазвичай є водно-спиртовою сумішшю. Його очищення та зневоднення починається з перегонки (ректифікації), якою можна досягти концентрації 95,6 % об. Утворена суміш є азеотропною і не може бути очищена подальшою перегонкою. Для додаткової дегідратації використовують бензен, циклогексан або гептан. Їхня присутність утворює нові азеотропні суміші із нижчою температурою кипіння, що дозволяє отримати безводний етанол.
У промислових масштабах для зневоднення можуть використовуватися молекулярні сита, чиї пори проникні для молекул води, але не для етанолу. Такі сита можуть бути штучними або з цеолітів природного походження (наприклад, з клиноптилоліту). 75 % адсорбованих молекул є водою, інші 25 % — етанол, який потім знову повертається в перегонну систему.
Також застосовується мембранний метод, який полягає в розділенні підігрітої до 60 °C водно-спиртової суміші напівпроникною мембраною, яка не пропускає етанол. Дана операція виконується під дією тиску менше 1 кПа. В результаті розділення утворюється етанол із концентрацією 99,85 % і розчин, що пройшов крізь мембрану, із концентрацією 23 %. Конденсований мембранний розчин може бути знову ректифікований.
Класифікація етанолу
Отримуваний спирт за своїм складом умовно поділяють на чотири класи:
- промисловий етанол (96,5 % об.) — продукт для промислового й технічного використання: як розчинник, паливо тощо. Для запобігання його вживанню зазвичай до нього додають речовини із неприємним запахом, наприклад, піридин у кількості 0,5—1 % (проводять денатурацію). Також для легшого визначення йому можуть надавати слабкого забарвлення метиловим фіолетовим;
- денатурований спирт — технічний продукт із концентрацією етанолу 88 % об., що має значну кількість домішок. Він денатурується і забарвлюється відповідним чином. Використовується в освітленні та обігріві;
- якісний алкоголь (96,0—96,5 % об.) — очищений етанол, що застосовується для потреб фармацевтики, у виготовленні косметичних засобів та для харчового споживання;
- абсолютний етанол (99,7—99,8 % об.) — надзвичайно чистий етанол, що застосовується у фармацевтиці, виготовленні аерозолів.
В Україні марки отримуваного ректифікованого етанолу регламентуються стандартом ДСТУ 4221:2003 «Спирт етиловий ректифікований». В залежності від ступеня очистки виділяється чотири сорти: «Пшенична сльоза», «Люкс», «Екстра» та «Вищої очистки».
| Показник | «Пшенична сльоза» |
«Люкс» | «Екстра» | «Вищої очистки» |
|---|---|---|---|---|
| Об'ємна частка етилового спирту, за температури 20 °C, %, не менше | 96,3 | 96,3 | 96,3 | 96,0 |
| Масова концентрація альдегідів, перерахунку на оцтовий альдегід у безводному спирті, мг/дм³, не більше |
2,0 | 2,0 | 2,0 | 2,0 |
| Масова концентрація сивушного масла: пропіловий, ізопропіловий, бутиловий, ізобутиловий та ізоаміловий спирти в перерахунку на суміш пропілового, ізобутилового та ізоамілового спиртів (3:1:1) в безводному спирті, мг/дм³, не більше |
2,0 | 2,0 | 2,0 | 2,0 |
| Масова концентрація сивушного масла, в перерахунку на суміш ізобутилового та ізоамілового спиртів (1:1) в безводному спирті, мг/дм³, не більше |
2,0 | 2,0 | 2,0 | 2,0 |
| Масова концентрація естерів, у перерахунку на оцтовоетиловий естер в безводному спирті, мг/дм³, не більше |
1,5 | 2,0 | 3,0 | 5,0 |
| Об'ємна частка метилового спирту, в перерахунку на безводний спирт, %, не більше |
0,005 | 0,01 | 0,02 | 0,03 |
| Масова концентрація вільних кислот (без СО2), в перерахунку на оцтову кислоту в безводному спирті, мг/дм³, не більше |
8,0 | 8,0 | 12,0 | 15,0 |
Хімічні властивості
Етанол є одноатомним первинним спиртом і гідроксильна група зумовлює більшість його хімічних властивостей. Так, етанол може брати участь у реакціях дегідратації — як внутрішньомолекулярної, так і міжмолекулярної:
При взаємодії з іншими спиртами утворюється суміш трьох етерів:
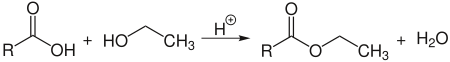
Із карбоновими кислотами етанол у присутності концентрованої сульфатної кислоти утворює естери:
В результаті приєднання етанолу до ацетилену синтезується винілетиловий етер:
Проявляючи свої кислотні властивості, етанол реагує з лужними металами (наприклад, натрієм) та лугами із утворенням етоксидів:
Ця реакція проводиться у безводному середовищі, оскільки гідроксид утворюється швидше, ніж етоксид.
Менш активні метали — алюміній та магній — також взаємодіють з етанолом, але тільки в присутності каталізатору ртуті:
Наявна у молекулі гідроксильна група може заміщатися галогенідними кислотами із утворенням галогенопохідних етану:
Етанол окиснюється до етаналю, а згодом — до оцтової кислоти; результатом повного окиснення (наприклад, спалювання етанолу) є діоксид вуглецю і вода:
Обробляючи етанол аміаком при 300 °C у кислому середовищі, утворюються заміщені аміни: первинні, вторинні, третинні або навіть четвертинні амонієві солі (в залежності від співвідношення реагентів):
Етанол є сировиною для синтезу бутадієну. Реакція проводиться при температурі 370—390 °C та в присутності каталізаторів — MgO-SiO2 або Al2O3-SiO2 (із селективністю 70 %):
Біологічна дія
Метаболізм
Майже увесь спожитий спирт (90—98 %) метаболізується організмом і лише невелика його частина (2—10 %) виводиться у незмінному вигляді: з сечею, повітрям, потом, слиною. Споживання етанолу призводить до надмірного сечовиділення: кожні 10 г алкоголю сприяють втраті організмом 100 мл рідини, що не сприяє видаленню спирту з організму. Основна частина етанолу, яка надійшла до організму, потрапляє до печінки, де в мікросомах зазнає біологічного перетворення.
На першій стадії метаболізму з етанолу утворюється ацетальдегід. Це відбувається під дією алкогольдегідрогенази (АДГ) — ферменту, кофактором якого є нікотинамідаденіндинуклеотид (НАД). Згодом ацетальдегід, утворений з етанолу, окиснюється в ацетат у мітохондріях ферментом альдегіддегідрогеназою, котра як кофермент використовує НАД, який, приєднуючи протон, відновлюється до НАД·Н. Піридинове кільце нікотинамідної частини коферменту відновлюється із утворенням дигідропіридину.
На цій стадії взаємодія відбувається набагато швидше, ніж на попередній. Ацетат надходить у цикл Кребса, де руйнується до СО2 і Н2О. Альдегіддегідрогеназу виявляють не тільки в печінці, а й в інших органах, включаючи головний мозок. У дорослої, здорової людини АДГ руйнує близько 10 г спирту на годину.
Окрім основного метаболічного процесу, етанол окиснюється також і двома іншими шляхами. Один з них відбувається за участі мікросомної оксидази у поєднанні з відновленим нікотинамідаденіндинуклеотидфосфатом (НАДФ), в той час як інший — за участі каталази в поєднанні з пероксидом водню. Обидва шляхи ведуть до утворення токсичного альдегіду, котрий має канцерогенні властивості і в десятки разів токсичніший порівняно з етанолом.
Вплив на організм
| Симптом | Вміст етанолу в крові, % |
|---|---|
| Розгубленість | 0,06—0,08 |
| Сповільнення мислення | 0,10 |
| Ступор | 0,11—0,15 |
| Сп'яніння | 0,16 |
| Значне отруєння | 0,2—0,4 |
| Смерть | 0,4—0,5 |
Потрапляючи до тіла людини через стравохід, етанол швидко всмоктується. У шлунку поглинається 20 % початкового етанолу, а у тонкому кишечнику — 80 %. Після поглинання він потрапляє у кров уже за 5 хвилин, розповсюджуючись із кровотоком по всьому організму.
Центральна нервова система. Етанол пригнічує функції ЦНС подібно до інших анестезуючих речовин. Попри поширену думку, етанол не стимулює дію ЦНС: якщо збудження і виникають, то їхня поява зумовлена протидією гальмівним процесам. У звичайних дозах етанол діє здебільшого на активуючу функцію ретикулярної формації стовбурової частини мозку і лише великі дози безпосередньо пригнічують функцію кори головного мозку.
Варто зауважити, що головний мозок складається у значній частині з ліпідів (10—12 %), розчинником яких є етанол, який проникає через гематоенцефалічний бар'єр. Відтак систематичне його вживання може призводити до втрати маси мозку.
При вживанні етанолу зменшується кількість нормохромних нейронів й зростає кількість гіпохромних нейронів та клітин-тіней (пустот від загиблих нейронів), що є свідченням токсичної дії алкоголю на нейрони.
Хронічне вживання етанолу спричинює дефіцит серотоніну. Функціональне зниження активності цієї системи перешкоджає розвитку толерантності і, навпаки, збільшення її активності, підвищення рівня серотоніну прискорюють розвиток толерантності до алкоголю. Під дією етанолу порушується обмін дофаміну, котрий бере участь у синтезі норадреналіну і координує рухи, емоційний та психічний стани. Також етанол чинить негативний вплив на фізичні і психічні можливості: він знижує гостроту зору та слуху, порушує м'язову координацію і стійкість, уповільнює час реакції на подразнення.
Дихальна система. Етанол має яскраво виражену токсичну дію на органи дихання. Ураження легень позначається розвитком бронхолегеневої інфекції внаслідок зменшення захисних функцій організму. Негативна дія алкоголю пов'язана з пригніченням фагоцитозу та утворення антитіл, сприянням проникненню бактерій у дихальні шляхи тощо. Бронхолегеневі патології можуть перерости у появу гострої пневмонії, котра має значний відсоток летальних випадків.
Серцево-судинна система. Під дією етанолу розчиняються ліпіди клітинних мембран, зокрема, у клітин міокарду. Внаслідок цього збільшується проникність мембран і порушується обмін іонів натрію, калію, магнію та кальцію. Це послаблює скорочувальну здатність серцевого м'яза.
Травна система. Одноразовий прийом зумовлює гострий геморагічний ерозивний гастрит; аналогічною є дія етанолу і на слизову оболонку дванадцятипалої кишки. Вже за хвилину після потрапляння у шлунок щурів етанол спричинював дифузну гіперемію слизової шлунка.
Печінка. Ступінь ушкодження печінки етанолом безпосередньо залежить від кількості спожитого алкоголю. Внаслідок його дії можуть з'являтися стеатоз, фіброз, алкогольний гепатит і цироз, що нерідко закінчується розвитком гепатоклітинної карциноми. Так, за даними Міжнародного агентства з дослідження раку етанол має канцерогенну дію.
Одним з результатів тривалого впливу на організм етанолу є збільшення об'єму еритроцитів — макроцитоз, спричинений токсичною дією ацетальдегіду, дефіцитом фолієвої кислоти та гіперліпідемією.
Алкоголізм
Етанол є основою спиртних напоїв. Їхнє тривале вживання спричинює появу алкоголізму.
Алкоголізм є сукупністю явищ, які характеризують клінічну картину залежності від алкоголю (тобто етаноловмісних продуктів). Серед симптомів та проявів такої залежності спостерігаються: толерантність організму до алкоголю, фізична залежність, синдром відміни у разі припинення або зменшення споживання, неконтрольоване і часом надмірне споживання.
Виділяють три стадії прогресу алкоголізму:
- у людини відсутній потяг до алкоголю, спостерігається втрата контролю при споживанні, перехід до систематичного споживання, збільшення толерантності до алкоголю, присутні початкові розлади у психічній сфері;
- наявна фізична залежність із втратою відчуття міри, формування психопатоподібного синдрому, порушення діяльності систем організму (серцево-судинної, сечостатевої, дихальної) та органів (поява гастриту, гепатиту);
- залежність від алкоголю є психічною, присутній сильний фізичний потяг як проявлення синдрому відміни, поява галюцинацій, незворотні ушкодження внутрішніх органів (цироз печінки, серцеві хвороби, енцефалопатія тощо).
Вплив на вагітність

Ризик виникнення відхилень у розвитку плоду є прямопропорційним кількостям спожитого під час вагітності алкоголю.
Етанол легко проникає крізь плаценту, тому його вміст у крові матері і плоду швидко досягає однакового рівня. Він накопичується в тканинах плоду, багатих на фосфоліпіди, у головному мозку, а також еритроцитах. Виведення алкоголю з організму здійснюється за допомогою ферментів печінки, а в майбутньої дитини вона формується лише в другій половині вагітності матері. Шкідливий вплив етанолу на плід пов'язаний з незрілістю захисного механізму й підвищеною проникністю судин тощо. Особливе значення мають критичні періоди ембріонального розвитку, коли чутливість ембріону й плоду до чужорідних речовин досягає максимального рівня. Токсична дія етанолу є причиною сповільнення розвитку або навіть загибелі ембріону.
Споживання матір'ю етанолу під час вагітності пов'язане з появою фетальних (плідних) тератогенних ефектів. Вплив алкоголю проявляється у порушенні загального розвитку плоду, народженні дитини з меншими, ніж у нормі, масою тіла і зростом, психічною неповноцінністю. Зокрема, уражені тератогенною дією етанолу діти мають видозмінені риси обличчя: вужчі очні щілини, тоншу верхню губу, появу мікроцефалії та ретрогнатії, відсутність фільтруму та різні вушні аномалії. Фізичні видозміни доповнюються недорозвиненістю головного мозку, схильністю до судомних нападів, набряків головного мозку, поганою координацією рухів, зниженням інтелекту і вродженими вадами серця. Таку дію етанолу названо фетальний алкогольний синдром, ФАС (або алкогольний синдром плоду).
Взаємодія з медичними препаратами
Етанол має здатність посилювати дію антибіотиків, антигістамінних препаратів, барбітуратів, м'язових релаксантів, а також викликати негативну реакцію організму.
| Клас препаратів | Препарат | Тип взаємодії з етанолом, наслідки |
|---|---|---|
| Анальгетики |
Аспірин Ацетамінофен |
Аспірин збільшує випорожнення шлунку, що веде до швидшої сорбції спирту у тонкому кишечнику, може сповільнювати у шлунку дію алкогольдегідрогенази. Етанол посилює метаболізм ацетамінофену, продуктом якого є токсичні речовини, що пошкоджують печінку. Можлива поява посиленого серцебиття, болів у животі, виразок шлунку, |
| Антибіотики |
Еритроміцин Ізоніазид Кетоконазол Метронідазол |
Еритроміцин збільшує випорожнення шлунку, що веде до швидшої сорбції спирту у тонкому кішківнику; спільно з ізоніазидом алкоголь підвищує ризик появи хвороб печінки. Супроводжується головнимим болями, нудотою, різкими змінами артеріального тиску |
| Антигістамінні препарати |
Димедрол Клемастин Прометазин |
Етанол підсилює вплив препаратів на ЦНС, спричинюючи появу млявості, зниження моторики; спільна дія сильніше позначається на літніх людях. |
| Барбітурати | Фенобарбітал | Слабкість організму, запаморочення, ризик судомного нападу. Хронічне вживання алкоголю підвищує рівень метаболізму барбітуратів цитохромом Р-450 |
|
Снодійно-седативні засоби (бензодіазепіни) |
Діазепам Лоразепам Оксазепам |
Етанол підсилює вплив препаратів на ЦНС, спричинюючи появу проблем із пам'яттю, млявості, зниження моторики, сповільнення або ускладнення дихання; |
| Протизапальні препарати |
Диклофенак Ібупрофен Напроксен |
Споживання етанолу збільшує ризик появи шлункової кровотечі, пептичних виразок |
| Блокатори H2-гістамінових рецепторів |
Нізатидин Ранітидин Циметидин |
Препарати пригнічують дію алкогольдегідрогенази та сприяють випорожненню шлунку, що веде до підвищення вмісту етанолу в крові. |
Застосування
Етанол має широкий спектр застосувань, серед яких найбільш значущими є виробництво спиртних напоїв, використання як розчинника, палива, а також синтез інших хімічних речовин.
Паливо

Перший автомобіль, що був здатен їздити на етанолі, спроєктував Генрі Форд у 1920 році — модель Ford T. Однак тоді ця інновація ще не отримала необхідного розвитку через технічні та економічні проблеми: виробництво чистого етанолу було надто дорогим, а використання недоочищеного спирту в суміші з вуглеводневим паливом було певною мірою обмеженим — за низьких температур нерозчинна у бензині вода замерзала, закорковуючи паливний бак.
Нині, маючи технології для виробництва дешевого етанолу, заміна традиційного бензинового чи дизельного палива етанолом, або використання його як добавки, набула у світі значного поширення. Світове виробництво етанолу для потреб паливної промисловості у 2014 році склало 24,75 млрд галонів.
Розчинник
Етанол є найбільш важливим розчинником після води. Його основним застосуванням є виробництво косметики, парфумів, поверхнево-активних речовин та дезінфектантів, фармацевтичних препаратів, різних покриттів. Для цих потреб застосовується етанол як синтетичного, так і ферментативного походження.
Антисептик
Етанол є найдавнішим антисептиком, відомим людству. Його здатність знезаражувати поранення була відзначена давньогрецьким лікарем Клавдієм Галеном, а пізніше і середньовічним французьким хірургом Гі де Шоліаком.
Етанол проявляє бактерицидні дії при концентрації 30 % і вище, залежно від типу бактерій, вмісту води та часу дії. Згідно з дослідженнями найбільш ефективною є дія етанолу при його концентрації 60—70 % — як у присутності води, так і за її відсутності. Саме такий вміст етанолу мають побутові антисептики для рук (наприклад, Септил). Використання вищої концентрації (наприклад, 90 % розчину) для дезінфекції шкіри недоцільне, оскільки при таких концентраціях етанол проявляє свої дубильні властивості, в той час як антисептичні властивості падають.
Принцип дії етанолу на мікроорганізми, ймовірно, полягає у впливі на їхні мембрани та швидкій денатурації білків, що призводить до порушення метаболізму бактерій та подальшого руйнування клітин. Етанол демонструє високу біоцидну дію проти вегетативних бактерій (включно з мікобактеріями), вірусів, грибів, але не спор.
Через відсутність спороцидної дії етанол не може бути використаний для стерилізації, проте його властивостей достатньо для профілактичного знезаражування поверхонь, обробки шкіри тощо.
Преципітація нуклеїнових кислот
Етанол широко застосовується в молекулярній біології для осадження та концентрування ДНК та РНК. Його використовують спільно із буферними розчинами солей, що містять прості однозарядні катіони (наприклад, катіони натрію). Типовим є використання буферу ацетату натрію концентрації 0,3 моль/л із pH 5,2 (при 4 °C) та етанолу — абсолютного і 70-відсоткового (при −20 °C).
Для осадження нуклеїнових кислот їхній зразок змішують із буферним розчином та абсолютним етанолом і охолоджують при −20 °C протягом години, після чого центрифугують. Відділивши піпеткою зайву рідину з поверхні, додають 70 % розчин етанолу та повторюють центрифугування і відділення рідини. Залишок випарюють при температурі 37 °C на водяній бані і таким чином отримують концентровану речовину.
Антидот
Завдяки більшій афінності до алкогольдегідрогенази, етанол використовується як доступний антидот при отруєннях метанолом, етиленгліколем та діетиленгліколем. В організм етанол вводять перорально або внутрішньовенно, а доза для введення розраховується із міркувань, що у сироватці крові його концентрація повинна сягати 10—15 мг/л.
Ризик у застосуванні етанолу полягає в пригніченні діяльності центральної нервової системи, появі гіпоглікемії (через зниження глюконеогенезу) та нудоти. При введенні внутрішньовенно можлива поява флебіту, гіпертонічність з гіпонатріємією. Застосування такого антидоту вимагає постійного моніторингу вмісту етанолу у сироватці та рівня глюкози. Проте інший антидот фомепізол значно дорожчий та менш доступний.
Синтез інших речовин
У промисловості етанол використовують для отримання етаналю, бутадієну, діетилового етеру, етилацетату, етиламіну тощо.
Див. також
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Logsdon, John E. Ethanol // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 9. — ISBN 978-0-471-48517-9. — DOI:10.1002/0471238961.0520080112150719.a01.pub2. (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Kosaric, N. et al. Ethanol // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI:10.1002/14356007.a09_587.pub2. (англ.)
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.
Посилання
- Абсолютний спирт [Архівовано 26 лютого 2022 у Wayback Machine.] // ВУЕ
|
| ||||||||||||||||||||||
| Ця стаття належить до добрих статей української Вікіпедії. |



































![{\mathrm {6C_{2}H_{5}OH+2Al{\xrightarrow {[Hg]}}\ 2(C_{2}H_{5}O)_{3}Al+3H_{2}\uparrow }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3f3c7e8bf23a5e49a8a28370f5373afe71bbaf8b)
![{\mathrm {2C_{2}H_{5}OH+Mg{\xrightarrow {[Hg]}}\ (C_{2}H_{5}O)_{2}Mg+H_{2}\uparrow }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fe51de79e5914546e22b038518cf9d2c883c07e)




