
Нікотинамідаденіндинуклеотид
| Нікотинамідаденіндинуклеотид | |
|---|---|
| |
| Інші назви | Дифосфопіридиннуклеотид (DPN+), Коензим I |
| Ідентифікатори | |
| Абревіатури | НАД, NAD |
| Номер CAS | 53-84-9 |
| Номер EINECS | 200-184-4 |
| DrugBank | 14128 |
| Назва MeSH | D03.633.100.759.646.138.694, D08.211.589, D13.695.667.138.694 і D13.695.827.068.694 |
| ChEBI | 13389 |
| RTECS | UU3450000 |
| SMILES | C1=CC(=C[N+](=C1)C2C(C(C(O2)COP(=O)([O-])OP(=O)(O)OCC3C(C(C(O3)N4C=NC5=C4N=CN=C5N)O)O)O)O)C(=O)N |
| InChI | |
| Властивості | |
| Молекулярна формула | C21H27N7O14P2 |
| Молярна маса | 663,43 г/моль |
| Тпл | 160 °C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Нікотинамідаденіндинуклеоти́д або НАД (англ. Nicotinamide adenine dinucleotide, NAD) — складна органічна сполука, кофермент, наявний у всіх живих клітинах, бере участь у всіх процесах метаболізму.
Зміст
Загальні відомості
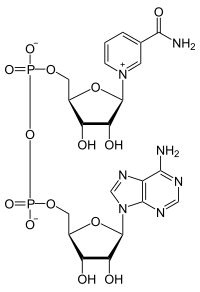
НАД є дінуклеотідом і складається з двох нуклеотидів, з'єднаних своїми фосфатними групами. Нікотинамідаденіндинуклеотид існує в двох формах: окисненої (NAD+, NADox) і відновленої (NADH, NADred).
Є небілковою частиною ферментів дегідрогеназ, які беруть участь у процесах окиснення органічних сполук у клітині. Молекула НАД складається з двох залишків п'ятивуглецевого цукру рибози, які з'єднані двома фосфатними групами. Один цукор зв'язаний з аденіном, а другий — з іншою азотистою основою — нікотинамідом. Фермент дегідрогеназа переносить атом водню з двома електронами з субстрату, що окиснюється, на кофермент НАД. Активною групою коферменту є амід нікотинової кислоти. Він приймає водень у вигляді гідрид-йону на піридинове кільце, інший атом водню у вигляді протону переходить у розчин. Цей процес є стереоспецифічним, одна група ферментів (алкогольдегідрогеназа, лактатдегідрогеназа) переносять водень на одну сторону піридинового кільця, інші (гліцеральдегідфосфатдегідрогеназа) — на іншу сторону. Таке дегідрування можна коротко описати рівнянням:
- CH3-CH2-OH + NAD+ → CH3-CH-O + NADH + H+
Кофермент вільно дисоціює, тобто можуть відділятися від одного ферменту й з'єднуватись з іншим, переносячи водень та електрони від молекули донора на молекулу акцептор. NADH переносить водень на попередників кінцевих продуктів бродіння або передає у дихальний ланцюг.
Хоча NAD+ записується з плюсом через формальний позитивний заряд атома азоту, за фізіологічних значеннях pH велика частина NAD+ насправді є аніоном з негативним зарядом -1, а NADH — аніоном з зарядом -2.
Окиснені та відновлені форми коферментів мають різні максимуми в спектрах поглинання світла. На цій властивості засновані оптичні методи визначення активності ферментів.
Фармакологічне та медичне застосування
Ферменти, залучені у синтезу, і використання NAD+, мають важливе значення для фармакології та досліджень, спрямованих на пошук нових способів лікування хвороб. При розробленні нових препаратів NAD+ розглядається з трьох позицій: як безпосередня мішень для ліків, для розробки інгібіторів і активаторів ферментів, що завдяки своїй структурі змінюють активність NAD-залежних ферментів, і для вивчення методів придушення біосинтезу NAD+.
Наразі сам по собі кофермент NAD+ не використовується для лікування жодних захворювань. Однак вивчається його потенційна роль у терапії нейродегенеративних захворювань, таких як хвороба Альцгеймера і хвороба Паркінсона. Є різні дані про дію NAD+ у нейродегенеративних хворобах. Деякі дослідження на мишах дають обнадійливі результати, проте клінічні випробування на людях з використанням плацебо не дали жодного ефекту.
NAD+ також є безпосередньою мішенню препарату ізоніазиду, що застосовується для лікування туберкульозу — інфекції, спричиненої бактерією Mycobacterium tuberculosis. Ізоніазид є проліками і при попаданні в клітину бактерії він активується пероксидазою, яка окиснює цю речовину до вільно-радикальної форми. Цей радикал далі реагує з NADH з утворенням аддуктів, які є дуже сильними інгібіторами ферментів редуктази білка-переносника еноіл-ацілу й дигідрофолатредуктази. В одному експерименті у мишей, яким давали NAD протягом тижня, поліпшувалося взаємодія клітинного ядра і мітохондрій.
Через величезну кількість оксидоредуктаз, що використовують NAD+ і NADH в якості субстратів і зв'язуються з ними за допомогою одного висококонсервативного структурного мотиву, ідея розроблення інгібітору, що блокує центр зв'язування NAD+, і специфічного лише для певного ферменту, здається сумнівною. Однак це може бути здійсненним: так, інгібітори, засновані на мікофеноліновій кислоті й тіазофурині, пригнічують інозинмонофосфатдегідрогенази у місті зв'язування з NAD+. Через важливу роль цього ферменту в метаболізмі пуринів ці сполуки можуть бути корисними протипухлинними і противірусними препаратами або імуносупресорами. Інші препарати не є інгібіторами, а, навпаки, активаторами ферментів, залучених в метаболізм NAD+. Інші препарати не є інгібіторами, а, навпаки, активаторами ферментів, залучених у метаболізм NAD+. Зокрема, цікавою мішенню для таких препаратів можуть бути сиртуїни, бо активація цих NAD-залежних деацетілаз збільшують тривалість життя. Такі сполуки, як резвератрол, збільшують активність цих ферментів, які можуть мати велике значення завдяки їх здатності до переносу старіння на пізніший строк як у хребетних, так і модельних організмів з числа безхребетних.
Через відмінності шляхів біосинтезу NAD+ у різних організмів, зокрема, між бактеріями і людиною, біосинтез NAD+ може стати новою сферою розвитку нових антибіотиків. Наприклад, фермент нікотинамідаза, перетворює нікотинамід у нікотинову кислоту, слугує мішенню розроблюваних ліків, так як цей фермент відсутній у людини, але є у бактерій і дріжджів.
Історія
Кофермент NAD+ був відкритий англійськими біохіміками Артуром Гарденом та Вільямом Янґом 1904 року. Вони помітили, що додавання прокип'яченого і профільтрованого екстракту дріжджів до непрокип'ячених екстрактів значно посилювало спиртове бродіння в останніх. Невідомий фактор, відповідальний за це явище, вони назвали коферментом. У ході тривалого і складного виділення з екстрактів дріжджів цей теплостійкий фактор був ідентифікований як нуклеотид-сахарофосфат Гансом Ейлером-Хельпіном. 1936 року німецький вчений Отто Генріх Варбург встановив функцію цього коферменту з перенесення гідридного йона і визначив, що в окисно-відновних реакціях бере участь нікотинамідний залишок.
Джерело нікотинаміду було визначено 1938 року, коли Конрад Елведжем виділив ніацин з печінки і показав, що цей вітамін містить нікотинову кислоту і нікотинамід. Пізніше, 1939 року, він надав перший переконливий доказ того, що ніацин використовується при утворенні NAD+. На початку 1940-х Артур Корнберґ зробив наступний крок до розуміння ролі NAD+ в метаболізмі: він першим встановив присутність цього коферменту в біосинтетичних шляхах. Далі, 1949 року американські біохіміки Морріс Фрідкін і Альберт Ленінджер довели, що NAD+ пов'язаний з такими метаболічними шляхами, як цикл трикарбонових кислот і окисне фосфорилювання. Нарешті, 1959 року Джек Прісс (англ. Jack Preiss) і Філіп Гандлер (англ. Philip Handler) описали ферменти і проміжні сполуки біосинтезу NAD+, тому шлях синтезу NAD+de novo часто називають шляхом Прісса — Гандлера на їхню честь.
Функції NAD і NADP, не пов'язані з окисно-відновними реакціями, були відкриті лише недавнім часом. Такою першою відкритою функцією NAD+ була участь у ролі донора ADP-рібозного залишку в реакціях ADP-рибозилювання; це було встановлено на початку 1960-х. Пізніші дослідження 1980-х і 1990-х років показали участь NAD+ і NADP+ у переданні сигналу між клітинами. Зокрема, дію циклічної ADP-рибози було встановлено 1987 року. Метаболізм NAD+ і XXI сторіччя залишається у сфері інтенсивних досліджень. Цей інтерес особливо зріс після відкриття 2000 року Шініхіро Імаі (англ. Shinichiro Imai) й співробітниками з Массачусетського технологічного інституту NAD+-залежних деацетілаз — сіртуїнів.
Література
- (англ.) David E. Metzler. Biochemistry: The Chemical Reactions of Living Cells. — 2nd edition. — Academic Press, 2003. — Т. 2. — 1973 с. — ISBN 978-0-1249-2541-0.
- (англ.) David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York : W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
- (англ.) Campbell N. A., Reece J. B., Urry L. A. e. a. Biology. 9th ed. — Benjamin Cummings, 2011. — 1263 p. — ISBN 978-0-321-55823-7.
- (рос.) Кольман Я., Рём К.—Г. Наглядная биохимия. — 4-е изд. — М. : БИНОМ. Лаборатория знаний, 2012. — 469 с. — ISBN 978-5-9963-0620-6.
- (рос.) Шлегель Г. Общая микробиология / Перевод с нем. Л. В. Алексеевой. — М. : Мир, 1987. — 567 с.
- (рос.) Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М. : Издательская группа «ГЭОТАР-Медиа», 2011. — 624 с.
Посилання
| |||||||||||
