Озонова діра
Озонова діра — локальне падіння концентрації озону в стратосфері на 10—40 %. Пов'язано це з дією фреонів, зменшенням кількості кисню при запусках космічних кораблів та польотами реактивних літаків. Чітко виявляється при надмірно низьких температурах. Загальноприйнята в науковому середовищі теорія, за якою в другій половині XX століття зростання дії антропогенного чинника у вигляді виділення хлор- і бромвмісних фреонів (CFC) призвело до значного зменшення озонового шару. Згідно з іншою гіпотезою, процес утворення «озонових дір» значною мірою є природним і не пов'язаний винятково зі шкідливою дією людської цивілізації.
Зміст
Історія
Озонова діра діаметром понад 1 000 км вперше була відкрита 1985 року в Південній півкулі над Антарктидою групою вчених Британської антарктичної експедиції, Джо Фарманом, Браяном Гардінером і Джоном Шенкліном. Вона з'являлася у серпні і до грудня або січня зникала. Завдяки глобальній боротьбі з викидами фреонів (Монреальський протокол), антарктична озонова діра з 1989 року стабільно зменшується на 0,8 %, що виведе локальний рівень атмосферного озону на показники 1980 року приблизно до 2075 року. Над Північною півкулею в Арктиці утворювалася інша діра, значно менших розмірів.
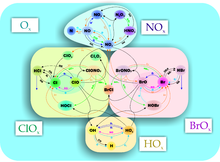
Механізм утворення
Механізм синтезу, а також розпаду (фотоліз) озону, запропонував Сідней Чепман 1930 року, а тому його названо його ім'ям. Реакції утворення озону:
• 3О2 + hν → 2О + 2О2 → 2О3
Фотоліз молекулярного кисню відбувається в стратосфері під впливом ультрафіолетового випромінювання з довжиною хвилі 175—200 нм і до 242 нм.
• О3 + hν → О2 + О
• О3 + O → 2О2
Озон витрачається в реакціях фотолізу і взаємодії з атомарним киснем: До зменшення концентрації озону в атмосфері веде сукупність чинників, головним з яких є руйнування молекул озону в реакціях з різними речовинами антропогенного і природного походження, відсутність сонячного випромінювання протягом полярної зими, особливо стійкий полярний вихор, який перешкоджає проникненню озону з приполярних широт, і утворення полярних стратосферних хмар (ПСХ), поверхню частинок якого каталізують реакції розпаду озону. Ці чинники особливо характерні для Антарктики, в Арктиці полярний вихор набагато слабший: через відсутність континентальної поверхні температура на декілька градусів вища, ніж в Антарктиці, а ПСХ менш поширені, до того ж мають тенденцію до розпаду на початку осені. Молекули озону (O3) хімічно дуже активні і можуть реагувати з багатьма неорганічними та органічними сполуками. Основними речовинами, що руйнують молекули озону, є:
- прості речовини (водень (H2), атоми кисню (O), хлору (Cl), брому (Br)),
- неорганічні сполуки (хлороводень (HCl), монооксид азоту (NO)),
- органічні сполуки (метан (CH4), фторхлор- і фторбромфреони, які виділяють атоми (Cl) і (Br)).
На відміну від гідрофторфреонів (HFC), які розщеплюються до атомів фтору, які, у свою чергу, швидко реагують з водою (H2O) утворюючи стабільний фтороводень (H2F2). Таким чином, фтор (F) не бере участі в реакціях розпаду O3. Йод також не руйнує стратосферний озон, оскільки йодовмісні органічні речовини майже повністю витрачаються ще в тропосфері.
Залежно від ланцюга реакцій, окрім механізму Чепмана (кисневий цикл Ox), виокремлюють ще три цикли руйнування озону: галогеновий, азотний, водневий. Діяльність людини збільшила галогенову частку розкладу захисного шару Землі. Частка розкладу озону залежно від циклу руйнування:
| Тиск (гПа) | азот | кисень | водень | галогени |
|---|---|---|---|---|
| 1,31 | 0,10 | 0,26 | 0,41 | 0,21 |
| 3,78 | 0,50 | 0,14 | 0,11 | 0,25 |
| 8,93 | 0,68 | 0,11 | 0,08 | 0,13 |
| 21,9 | 0,46 | 0,12 | 0,19 | 0,20 |
| 55,8 | 0,12 | 0,03 | 0,48 | 0,14 |
Хлорний цикл ClOx
Хлорний цикл є різновидом галогенного циклу.
• CFCl3 + hν → CFCl2 + Cl
• Cl + O3 → ClO + O2
• ClO + O → Cl + O2
Азотний цикл NOx
Оксиди азоту грають важливу роль в реакціях руйнування озону в середній стратосфері. Не зважаючи на те, що азоту в атмосфері більше, ніж будь-якого іншого газу, утворення його оксидів безпосередньо з молекулярного азоту замале, оскільки молекула N2 дуже стабільна, фактично інертна. Для її розпаду потрібно багато енергії, наприклад розряд блискавки або дуже жорстке випромінювання, сонячні протони або галактичне випромінювання. В стратосфері цього немає, тому основним джерелом оксидів озота (NOx) є закис азоту (N2O), який утворюється на поверхні Землі і в океанах головним чином результатом діяльності бактерії. Людина теж вносить свій внесок — третина від всього закису азоту. Головною реакцією, за якою N2O перетворюється в NOx є наступна:
• N2O + O(1D) → NO + NO
Вона може протікати тільки вдень, тільки за наявності Сонця. Потім NO вступає в реакцію з озоном, водночас руйнуючи його, що приводить до утворення іншого оксиду азоту, NO2:
• О3 + NO → NO2 + О2
Ця реакція може протікати і вночі, тому концентрація двоокису азоту росте в темний час доби, оскільки вдень вона перетворюється назад по реакціях:
• NO2 + О → NO + О2
• NO2 + hν → NO + О
Третій оксид азоту, вже з трьома атомами кисню в молекулі, який знову таки реагує з озоном:
• NO2 + О3 → NO3 + О2
Він перетворюється назад в NO і NO2 через фотоліз:
• NO3 + hν → NO2 + O
• NO3 + hν → NO + О2
Тому знову таки його вночі більше, ніж вдень. Таким чином, оксиди азоту реагуючи з озоном збільшують число атомів кисню в своїх молекулах, а потім втрачають їх в реакціях з атомарним киснем або при фотолізі. Сумарно це приводить до загибелі озону. Процес цей ланцюговий і циклічний, оксиди азоту в ньому можуть розглядатися як каталізатори.
Водневий цикл HOx
Іншою важливою родиною речовин, що руйнують озон, є замісники OH- і HO23+, об'єднувані загальною формулою HOx. Їх можна розглядати як оксиди водню. Проте на відміну від звичайних оксидів вони дуже реакційнопотентні (не можуть існувати як речовина, оскільки володіють неподіленою електронною парою, тобто є замісниками). Якщо два такі замісники зустрінуться разом, то вони прореагують один з одним, рекомбінують, утворюючи зовсім іншу речовину, наприклад два HO- замісники дадуть перекис водню (H2O2). Основним джерелом утворення HOx є реакція водяної пари з сінглетним атомом кисню:
• Н2O + О(1D) → OH + OH
Ця реакція дуже схожа на реакцію в якій закис азоту N2O, реагуючи теж з сінглетним киснем дає дві молекули NO. Важлива реакція з метаном:
• СН4 + О(1D) → СН3 + OH
Аналогічні реакції:
• ОН + О3 → НО2 + О2
• НО2 + О → ОН + О2
• НО2 + О3 → ОН + 2О2
В них гинуть дві молекули озону і регенерується OH- замісник, цикл замикається. OH- далі знову вступає в реакцію з озоном. Повний хімічний механізм складається з сотень реакцій.
Наслідки

Ослаблення озонового шару посилює потік сонячної радіації на землю і викликає у людей зростання числа ракових утворень шкіри. Також від підвищеного рівня випромінювання страждають рослини і тварини.
Стан озонового шару в Україні
В Україні спостереження за станом озонового шару проводяться на чотирьох озонометричних станціях у Києві, Борисполі, Одесі, Львові (до 2014 року проводилось також на Кара-Дагу в Криму). За даними цих спостережень, протягом останніх 10 років загальний вміст озону в атмосфері був значно нижчим від кліматичної норми (аналогічна картина спостерігалася для всієї північної півкулі Землі в межах широт 40—60°). Для виявлення озонових аномалій аналізується відхилення значень загального вмісту озону в одиницях стандартного відхилення а. Якщо ці відхилення становлять від — 2,0 а до — 2,5 а, то це свідчить про критичну ситуацію, а коли перевищують значення –2,5 а, то констатується озонова аномалія («діра»). Протягом 2000 р. озонових аномалій над Україною не спостерігалося, проте було зафіксовано кілька випадків зменшення вмісту озону до критичних значень[джерело?].
Відновлення
Хоча людством були вжиті заходи з обмеженню викидів хлор- і бромвмісних фреонів шляхом переходу на інші речовини, наприклад фторвмісні фреони (CFC), процес відновлення озонового шару триватиме декілька десятиріч. Перш за все це зумовлено величезним об'ємом вже накопичених в атмосфері фреонів, які мають час життя десятки і навіть сотні років. Тому затягування озонової діри не варто чекати раніше 2048 року.
Упередження стосовно озонової діри
Існує декілька поширених міфів стосовно утворення озонових дір. Незважаючи на свою ненауковість, вони почасти з'являються в ЗМІ — іноді завдяки непоінформованості, іноді підтримувані прихильниками теорій змов. Нижче перераховано деякі з них.
Основними руйнівниками озону є фреони
Це твердження справедливе для середніх і високих широт. У високих широтах (де виникають озонові діри) хлорний цикл відповідальний лише за 15—25 % втрат озону в стратосфері. Необхідно відзначити, що 80 % хлору (Cl) має антропогенне походження. Тобто втручання людини збільшує внесок хлорного циклу. У разі збереження тенденції щодо збільшення виробництва фреонів, яка була до вступу в дію Монреальського протоколу) (зростання 10 % на рік) 2050 року 30 %—50 % загальних втрат озону обумовлювалось би дією фреонів (CFC). До втручання людини процеси утворення озону і його руйнування перебували в рівновазі. Але фреони, що викидаються при людській діяльності, зсунули цю рівновагу у бік зменшення концентрації озону. Що ж до полярних озонових дір, то тут ситуація абсолютно інша. Механізм руйнування озону в принципі відрізняється від низьких широт, ключовою стадією є перетворення неактивних форм галогеновмісних речовин в оксиди, яке протікає на поверхні частинок ПСХ. В результаті практично весь озон руйнується в реакціях з галогенами:
Фреони дуже важкі, щоб досягти стратосфери
Іноді стверджується, що оскільки молекули фреонів набагато важчі за азот (N2) і кисень (O2), то вони не можуть досягти стратосфери в значних кількостях. Проте атмосферні гази перемішуються повністю, а не розшаровуються або сортуються по вазі. Процеси вертикального переносу повітряних мас, конвекції і турбулентності повністю перемішують атмосферу нижче турбопаузи набагато швидше. Тому навіть такі важкі гази, як інертні або фреони (CFC), рівномірно розподіляються в атмосфері, досягаючи, зокрема, і стратосфери. Експериментальні вимірювання їх концентрацій в атмосфері підтверджують це, дивіться наприклад графік праворуч. Також вимірювання показують, що потрібно близько 5 років для того, щоб гази, що виділилися на поверхні Землі досягли стратосфери. Якби гази в атмосфері не перемішувалися, то такі важкі гази з її складу як аргон (Ar) і вуглекислий газ (CO2) утворювали б на поверхні Землі шар в декілька десятків метрів товщиною, що зробило б її нежилою. На щастя це не так. Криптон (Kr) з атомарною масою 84, і гелій (He) з атомарною масою 4, мають одну і ту ж відносну концентрацію, що біля поверхні, що на висоті 100 км. Звичайно, все вищенаведене вірне лише для газів, які порівняно стабільні, як фреони чи інертні. Речовини, які вступають в реакції, а також піддаються різному фізичному впливу, скажімо, розчиняються у воді, мають залежність концентрації від висоти.
Основні джерела галогенів природні, а не антропогенні
Є думка, що природні джерела галогенів, наприклад вулкани або океани, більш значущі для процесу руйнування озону, ніж діяльність людини. Не ставлячи під сумнів внесок природних джерел в загальний баланс галогенів, необхідно відзначити, що в основному вони не досягають стратосфери з огляду на те, що є водорозчинними (в основному хлорид-йони (Cl-) і хлороводень (HCl)) і вимиваються з атмосфери, випадаючи у вигляді дощів на землю. Також природні з'єднання менш стійкі, ніж фреони, наприклад метилхлорид (CH3Cl) має атмосферний час життя всього порядка року, в порівнянні з десятками і сотнями років для фреонів. Тому їх внесок в руйнування стратосферного озону досить малий. Навіть рідкісне за своєю силою виверження вулкана Пінатубо в червні 1991 року викликало падіння рівня озону не за рахунок галогенів, що вивільняються, а за рахунок утворення великої маси сірчанокислих аерозолів (SO42-), поверхня яких каталізувала реакції руйнування озону. На щастя, вже через три роки практично вся маса вулканічних аерозолів була видалена з атмосфери. Таким чином, виверження вулканів є порівняно короткостроковими чинниками дії на озоновий шар, на відміну від фреонів, які мають часи життя в десятки і сотні років.
Озонова діра повинна розташовуватися над джерелами фреонів
Багато хто не розуміє, чому озонова діра утворюється в Антарктиці, у той час як основні викиди фреонів відбуваються в Північній півкулі. Річ у тому, що фреони добре перемішані в тропосфері і стратосфері. З причини малої реакційної здатності вони практично не витрачаються в нижніх шарах атмосфери і мають термін життя в декілька років або навіть десятиріччя. Тому вони легко досягають верхніх шарів атмосфери. Антарктична «озонова діра» існує не постійно. Вона з'являється наприкінці зими — на початку весни. Причини, за якими озонова діра утворюються в Антарктиці, пов'язані з особливостями місцевого клімату. Низькі температури антарктичної зими приводять до утворення полярного вихору. Повітря усередині цього вихору рухається здебільшого замкнутими траєкторіями навколо Південного полюса. В цей час полярна область не освітлюється Сонцем, і там озон не утворюється. З настанням літа кількість озону збільшується і знову приходить до норми. Тобто коливання концентрації озону над Антарктикою — сезонні. Проте, якщо відстежити зміни усередненої протягом року концентрації озону і розміру озонової діри протягом останніх десятиріч, то є певна тенденція до падіння концентрації озону.
Озон руйнується тільки над Антарктикою
Це неправильно, бо рівень озону падає всюди. Це показують результати довготривалих вимірювань концентрації в різних точках планети. Ви можете подивитися на графік зміни концентрації озону над Аросою в Швейцарії праворуч.
Цікаві факти
Генеральна асамблея ООН спеціальною резолюцією № A/RES/49/114 в 1994 році оголосила 16 вересня щорічним Міжнародним днем охорони озонового шару (англ. International Day for the Preservation of the Ozone Layer).
Див. також
Література
- Корсак В. В., Коцаренко М. Я. Озонова діра — сигнал небезпеки. — К. : т-во «Знание», УРСР, 1990. — 48 с. — (Вдумливим, допитливим, кмітливим)
- И. К. Ларин. Химия озонового слоя и жизнь на Земле // Химия и жизнь — XXI век. — 2000. — № 7. — С. 10-15. (рос.)
- Andrew Dessler. The Chemistry and Physics of Stratospheric Ozone. Academic Press — 2000. (англ.)
- Dotto, Lydia and Schiff, Harold. The Ozone War. Doubleday — 1978. ISBN 0-385-12927-0 (англ.)
- Roan, Sharon (1990). Ozone Crisis, the 15 Year Evolution of a Sudden Global Emergency. Wiley. ISBN 0-471-52823-4 (англ.)
- Cagin, Seth and Dray, Phillip. Between Earth and Sky: How CFCs Changed Our World and Endangered the Ozone Layer. Pantheon — 1993. ISBN 0-679-42052-5 (англ.)
- Benedick, Richard E. (1991). Ozone Diplomacy. Harvard University Press. ISBN 0-674-65001-8 (англ.)
- Litfin, Karen T. (1994). Ozone Discourses. Columbia University Press. ISBN 0-231-08137-5 (англ.)
- Newman, P. A., Kawa, S. R. and Nash, E. R. (2004). «On the size of the Antarctic ozone hole?». Geophysical Research Letters 31: L12814. (англ.)
- E. C. Weatherhead, S. B. Andersen (2006). «The search for signs of recovery of the ozone layer». Nature 441: 39-45. (англ.)
- Eike Roth. «Globale Umweltprobleme — Ursachen und Lösungsansätze», Friedmann Verlag, München — 2004. ISBN 3-933431-31-X (нім.)
- World Meteorological Organization, Scientific assessment of ozone depletion: 2002, Global Ozone Research and Monitoring Project — Report No. 47, 498pp., Geneva — 2003 ISBN 92-807-2261-1 (англ.)
- Martin Dameris, Thomas Peter, Ulrich Schmidt, Reinhard Zellner. «Das Ozonloch und seine Ursachen». Chemie in unserer Zeit 41(3), S. 152—168 (2007), ISSN 0009-2851 (нім.)
- А. Д. Данилов, И. Л. Кароль. «Атмосферный озон — сенсации и реальность». — Л. Гидрометиоиздат 1991. (рос.)
- Ф. С. Ортенберг, Ю. М. Трифонов. Озон: взгляд из космоса.9./90. М. Знание 1990. (рос.)
- Ш. Роун. «Озоновый кризис. Пятнадцатилетняя эволюция неожиданной глобальной опасности». — М. «Мир» 1993. (рос.)
- Э. Александров, Ю. А. Израэль, И. Л. Кароль, А. Х. Хргиан. «Озоновый щит Земли и его изменения». — СПб. Гидрометиоиздат 1992. (рос.)
- А. Д. Стрижевский. Свет. Природа и человек 4/92. (рос.)
- Г. Фелленберг. «Загрязнение природной среды». М. «Мир» 1997. (рос.)
Посилання
- «Діра» озонова // Словник-довідник з екології : навч.-метод. посіб. / уклад. О. Г. Лановенко, О. О. Остапішина. — Херсон : ПП Вишемирський В. С., 2013. — С. 70.
- The ozone hole. (англ.)
- Environmental Effects of Ozone Depletion: 1994 Assessment. (англ.)
- Scientific Assessment of Ozone Depletion 2002. (англ.)
- Fahey, D.W. & etc.: «Twenty Questions and Answers About the Ozone Layer 2002». Scientific Assesment of Ozone Depletion. (англ.)
- Assessment of Ozone Depletion 2006.[недоступне посилання з липня 2019](англ.)
- Віденська конвенція про охорону озонового шару (рос.)
- Монреальський протокол (рос.)
- Озоновий шар Землі (рос.)