Фоторецептор


Фоторецептори — безспайкові світлочутливі сенсорні нейрони, розташовані у зовнішньому ядерному шарі сітківки ока.
Фоторецепторний шар сітківки утворює двовимірну мозаїку, що перетворює безперервне зображення тривимірного світу, сформоване кришталиком та рогівкою ока, в масив дискретних сигналів, які потім обробляються нижче розташованими нейронами сітківки і через оптичний нерв передаються до мозку, до вищої зорової системи.
Сітківка хребетних містить два класи фоторецепторів — палички та колбочки, що мають чотири характерні лише для фоторецепторів структурно-функціональні складові: зовнішній сегмент, внутрішній сегмент, з'єднувальна війка та унікальні в усій нервовій системі синаптичні закінчення, які неперервно вивільняють нейромедіатор за відсутності стимулу. Колбочки і палички різняться між собою морфологією, чутливістю та реакцією на світло, структурою фоточутливих пігментів і діапазоном покриття інтенсивностей світла.
Палички, яких в сітківці людини лише один тип, відповідають за зір при тьмяному і нічному освітленні (скотопічний зір) і дозволяють зоровій системі досягнути меж, накладених поглинанням одиничних фотонів. Коли палички повністю адаптовані до темряви, то можуть реагувати на одиничні фотони.
Колбочки менш чутливі до світла, але забезпечують гостроту зору. Сітківка більшості ссавців має два типи колбочок, а людини і деяких мавпових три типи, які є максимально чутливими до трьох кольорів (червоного, зеленого та синього). Поєднання відносних інтенсивностей цих трьох основних кольорів дозволяє людському зору визначити колір будь-якого об'єкта. Відтак, колбочки відповідальні за денний (фотопічний) зір.
Поступове зменшення рівня освітлення, від яскравого денного світла до тьмяного нічного, обумовлює перехід зору від колбочок до паличок. Цей перехід супроводжується зміщенням діапазону максимальної зорової чутливості до синього кінця спектру видимого світла — ефект, відомий як «зміщення Пуркинє». Зміщення Пуркинє пов'язане із сутінковим (мезопічним) зором, що є проміжним між фотопічним та скотопічним.
Колбочки у центральній ямці сітківки приматів формують регулярну трикутну мозаїку. З віддаленням від центральної ямки регулярність мозаїки колбочок швидко спадає.
Фоторецептори відповідають гіперполяризацією (а не деполяризацією, як інші нейрони) у відповідь на адекватний цим рецепторам сигнал — світло. Окрім того, на відміну від більшості нейронів, фоторецептори передають електричні сигнали не через потенціали дії (спайки), а через градуйовані змінимембранного потенціалу. А унікальна морфологія фоторецепторів наділяє їх рисами, подібними до оптичних хвилеводів.
Потреба підтримувати градієнт концентрації іонів у фоторецепторах і їх тонічна деполяризація за відсутності світла робить сітківку однією з найбільш метаболічно активних тканин тіла. Тому перетворення фоторецепторами світла в електричні сигнали (фототрансдукція) є одним з найбільш енергозатратних процесів організму тварин.
Фоторецептори формують та передають всю просторово-часову інформацію, що доступна вищим рівням зорової системи. Розмір, щільність розташування, спектральна чутливість та електричні реакції фоторецепторів накладають нездоланні обмеження на часову, просторову та кольорову інформацію, яку ЦНС може вилучити із зображення на сітківці.
В 1991 році з'ясувалося, що зоровий пігмент меланопсин є не лише в паличках і колбочках, а й в окремому відносно невеликому класі гангліозних клітин ссавців; таким чином, ці клітини є третім класом фоторецепторів сітківки на додачу до паличок і колбочок. Оскільки фотовідгук меланопсину значно повільніший, аніж відгук опсинів паличок та колбочок, то вважається, що ці світлочутливі гангліозні нейрони сітківки (ipRGC) не мають значної ролі у формуванні зорового сприйняття чи взагалі не залучені до процесу зору, а їх головною функцією є регулювання циркадних ритмів та розмірів зіниці ока у відповідь на світло. Однак накопичується все більше даних, що світлочутливі гангліозні нейрони все ж можуть кодувати просторову зорову інформацію та формують візуальне сприйняття на ранніх етапах обробки зорових зображень.
Зміст
- 1 Фоторецепторний шар сітківки
- 2 Теорія подвійності зору
-
3 Зоровий пігмент
- 3.1 Відкриття зорового пігменту
- 3.2 Структура зорового пігменту
- 3.3 Класи фотопігментів
- 3.4 Генетичне кодування фотопігменту
- 3.5 Спектральна чутливість фотопігменту
- 3.6 Регулювання спектральної налаштованості фотопігменту
- 3.7 Колір та довжина хвиль світла
- 3.8 Принцип уніваріантності
- 3.9 Фотопігменти триколірного зору
- 4 Структура фоторецепторів
- 5 Класифікація фоторецепторів
- 6 Фототрансдукція
- 7 Фоторецепторний відгук на світло
- 8 Фоторецепторний шум
- 9 Міжрецепторні електричні з'єднання
- 10 Палички і колбочки: відмінність та подібність
- 11 Оптичні властивості фоторецепторів
- 12 Див. також
- 13 Джерела
Фоторецепторний шар сітківки

Сітківка — це шар тканини ока, що трансформує світло у зорові сигнали, які передають інформацію про видимий зовнішній світ до мозку. Трансформація світла в електричні сигнали починається на рівні двох класів фоторецепторів сітківки — паличок та колбочок.
Сітківка хребетних знаходиться попереду пігментного епітелію, клітини якого заповнені темним пігментом меланіном, що поглинає все те світло, яке не схоплюється сітківкою. Це унеможливлює відбиття світла назад у сітківку і погіршення зорового зображення.
Фоторецептори знаходяться на задній стінці ока, одразу перед пігментним епітелієм, тому всі інші нейрони сітківки розміщені перед фоторецепторами, ближче до кришталика ока. Така перевернута будова сітківки призводить до того, що світло повинно пройти через всі шари її нейронів, перш ніж потрапить до фоторецепторів. Щоб світло дійшло до фоторецепторів без поглинання та значного розсіяння, нейронні аксони в ближчих шарах сітківки позбавлені мієлінової оболонки, забезпечуючи відносну прозорість цих шарів.
Палички і колбочки щільно розміщені в сітківці, займаючи ~90 % двовимірного фоторецепторного шару, інші 10 % — це позаклітинний простір. У сітківках тварин, що ведуть денний і нічний спосіб життя (напр., людина, макака, кішка, кролик), близько 5 % всіх рецепторів становлять колбочки, всі інші — палички. У сітківці ссавців, за невеликим винятком (деякі ховрахи мають тільки колбочки), відношення паличок до колбочок є навдивовижу сталим — 20:1. Оскільки потік фотонів при денному світлі є значно більшим, ніж вночі, то вдень сітківка може спиратись на меншу кількість фоторецепторів, які ефективно схоплюють надлишкову кількість фотонів, тоді як в темряві важливий кожен фотон, що потребує більшої кількості паличок.
Фоторецептори в центральній ямці
Протягом еволюції ока відбулась характерна спеціалізація сітківки — істотне зміщення щільності фоторецепторів та нейронів. Тоді як у ссавців нижчого порядку, наприклад, щурів та мишей, щільність клітин в сітківці є рівномірною, то в центрі сітківки ссавців вищого порядку, наприклад, котів та приматів, з'явилось невелике поглиблення — т. зв. центральна ямка (fovea centralis, ~1 мм в діаметрі, покриває близько 3 градусів зорового поля) — де нейрони зміщені в бік, дозволяючи фоторецепторам в цій ділянці отримувати найменш викривлене зорове зображення. Таке зміщення є найбільш явним в середині центральної ямки, фовеолі (~300 мкм в діаметрі). У фовеолі відсутні палички і є найбільша концентрація колбочок, які уможливлюють найкращу гостроту та високу роздільну здатність зору. Замість збільшення фоторецепторів та інших нейронів в усій сітківці для забезпечення вищої гостроти зору, що б також потребувало істотного збільшення розмірів ока, подібна спеціалізація обмежена невеликою ділянкою ока. Щоб фіксувати погляд на речах і бути в змозі розгледіти їх більш детально, очі повинні постійно рухатись, уможливлюючи проєкцію зорового зображення на центральну ямку. Тому протягом споглядання людина робить чисельні рухи очей, близько 3 рухів/с.
Центральна ямка в очах людини є неглибокою і має ~570 мкм в діаметрі, містячи до 200 тис. довгохвильових та середньохвильових колбочок / мм2. Середня відстань між ними (від центру до центру) становить від 2 до 2,5 мкм, тобто, на 1 градус поля зору потрапляє ~120 колбочок. Це достатньо для формування зображення ґратки з періодом 1/60 градуса, що і є межею роздільної здатності зору людини). (Для порівняння, щільність колбочок в центральній ямці сітківки орла клинохвостого становить ~1 млн колбочок/мм2, що відповідає вдвічі більшій гостроті зору (роздільна здатність 1/143 градуса), ніж у людини, досягаючи біофізичної межі можливої щільності колбочок, оскільки ще більша щільність колбочок потребуватиме тонших внутрішніх сегментів, чий хвилевідний механізм не зможе запобігти розсіянню фотонів на сусідні колбочки.)
У сітківці людини на відстані 5 градусів від центральної ямки щільність колбочок спадає в 10 разів (до 20 тис. колбочок/мм2), а на відстані 10 градусів — ще вдвічі (10 тис. колбочок/мм2). Зі збільшенням відстані від центру сітківки збільшується і діаметр колбочок: у центральній ямці він становить 1—2 мкм, а на відстані в 10 градусів — 4—10 мкм, після чого залишається відносно сталим. Тварини, які мають менш гострий денний зір, ніж людина, але кращий зір вночі, мають зменшену щільність колбочок в центральній ямці задля збільшення кількості паличок в сітківці. Так, щільність колбочок в центральній ямці кішки майже вдесятеро менша (30 тис. / мм2) ніж у людини, завдяки чому у них збільшується щільність паличок до 200 тис. / мм2.
На відміну від колбочок, палички відсутні у фовеолі, однак їх щільність швидко зростає із відстанню від центру, досягаючи максимальної щільності за 3 мм (20 градусів) від центральної ямки (160 тис. паличок/мм2). Звідси концентрація паличок спадає більш поступово, досягаючи 35 тис./ мм2 на периферії сітківки. Також, на відміну від колбочок, діаметр паличок швидко не зростає зі збільшенням їх щільності, залишаючись відносно сталим (~1,5 мкм) одразу з їх появою поза фовеолою і збільшуючись на периферії сітківки (4 мкм).
Сітківка також містить ділянку, відому як оптичний диск — місце, де зоровий нерв відходить із сітківки до мозку. В цій ділянці не знаходиться жодного фотороцептора, тому вона постає як сліпа пляма в зоровому полі. Зоровий нерв містить 106 нервових волокон (утворюються аксонами гангліозних клітин), що з урахуванням кількості колбочок і паличок в сітківці (6,5×106 та 120×106 відповідно) вказує на високий коефіцієнт конвергенції із фоторецепторів до гангліозних клітин, порядку 120/1.
Фоторецептори сітківки організовані мозаїчно в один шар, що формує синаптичні зв'язки з нижчестоячими нейронами — горизонтальними та біполярними нейронами в зовнішньому сітчастому шарі.
Теорія подвійності зору
Ідея, що зорова система хребетних поділяється на дві морфологічно та фізіологічно відмінні підсистеми (паличкову та колбочкову), лежить в основі теорії подвійності зору.
Відкриття фоторецепторів
1722 р., вивчаючи сітківку людини, Антоні ван Левенгук скоріш за все був одним з перших, хто через мікроскоп побачив фоторецептори, хоча він не розумів їх функціональної ролі. Тільки через століття фоторецептори в зовнішній сітківці були виявлені, виокремлені та описані. В 1830-х рр. німецький лікар та природознавець Готфрід Тревіранус виявив фоторецептори,, вивчаючи під мікроскопом сітківки риб, земноводних, ссавців та птахів. Хоча він і пов'язав функцію виявлених ним паличок (які він назвав «пухирцями») зі сприйняттям світла, Тревіранус вважав, що фоторецептори спрямовані до склоподібної камери ока, а не від неї, і оптичний нерв (чиї закінчення він, продовжуючи декартову традицію, вважав рецепторними елементами) на його думку повинен був відходити позаду рецепторів.
Як відзначали пізніше інші дослідники сітківки, «хоча дослідження (анатомії сітківки) Тревірануса були хибними майже у всьому, вони були корисними, оскільки стимулювали одразу серію нових досліджень». Вперше на те, що фоторецептори перевернуті, вказав анатом та фізіолог Фрідріх Біддер (1839), який виявив, що закінчення паличок витягнуті до хоріоідеї ока. Однак і Біддер, подібно до Тревірануса, не міг зрозуміти, яким чином перевернуті фоторецептори можуть реагувати на світло, тому зводив їх функцію лише до віддзеркалення світла через волокна оптичного нерва.
Німецький анатом та фізіолог Генріх Мюллер в 50-х рр. ХІХ ст. описав перевернуту природу фоторецепторів і, паралельно зі швейцарським фізіологом Альбертом фон Келлікером, та вперше вказав два окремі їх типи (палички і колбочки). Вказавши, що палички на відміну від колбочок мають багрянистий колір, Мюллер, однак ще не зміг визначити, що ці фоторецептори мають різні зорові функції.
Зміщення Пуркіне

Одним з перших психофізичних свідчень існування двох відмінних систем зору, паличкової та колбочкової, було відкриття в 1820-х рр. чеським фізіологом та анатомом Яном Пуркинє, феномену зміщення максимальної чутливості ока в напрямку синього кінця спектру видимого світла зі зменшенням рівня освітленості.
Пуркинє помітив, що відносна яскравість різних кольорів змінюється зі зміною загального рівня освітлення. Він відмітив, що сині та червоні квіти, незалежно від їх різниці в кольорі, виглядають для нього однаково яскраво при денному світлі. Однак при дуже тьмяному світлі, в сутінках чи на світанку, червоні квіти виглядають темно-червоними чи майже чорними, тоді як він все ще може бачити синій колір квіток, які виглядають яскравішими.
Хоча сам Пуркіне не вважав своє відкриття важливим, саме цей феномен, відомий як «ефект Пуркинє» або «зміщення Пуркинє», свідчив про існування подвійної системи зору — колбочкового кольорового зору, що функціює при яскравому освітленні та паличкового зору при тьмяному освітленні. Пізніше феномен зміщення Пуркинє був виявлений також в жаб, котів, ховрахів, акул і навіть двокрилих, засвідчуючи в них існування подвійної системи зору.
В основі ефекту Пуркинє (зміщення найяскравішої області спектру зі зміною освітленості від червоного до синього кольору) є різниця між скотопічною, паличковою спектральною чутливістю (з піковою довжиною хвилі 500 нм) та фотопічною, колбочковою спектральною чутливістю (пік 555 нм). Інтенсивності голубого та червоного світла, що відбиваються від квіток, стимулюють колбочки майже в однаковій мірі при денному освітленні. Однак при сутінковому і тьмяному світлі на відміну від колбочок, палички продовжують функціювати і, оскільки вони є більш чутливими до коротких довжин хвиль світла (синього кінця спектру), тому продовжують сприймати сині квіти, коли вже колбочки починають сприймають червоні як відтінки сірого чи майже чорні. Окрім іншого, зміщення Пуркинє є одним із важливих свідчень, що палички поряд з колбочками залучені до формування кольорового зору.
Втім, для підтвердження поведінкового відкриття Пуркинє відмінності двох систем зору потрібні були однозначні анатомічні та фізіологічні свідчення відмінностей між їх фоторецепторами, паличками та колбочками.
Теорія подвійності Шульце
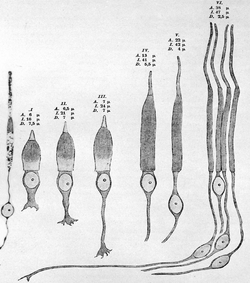
Першим хто однозначно вказав на функціональну відмінність між паличками та колбочками, був відомий німецький анатом Макс Шульце, який у серії статей 1866—1867 рр. показав подвійність сітківки хребетних і заклав основи теорії подвійності зору.
Для розрізнення паличок від колбочок Шульце спирався на їх морфологію, що стало врешті класичним критерієм для виділення типів фоторецепторів. Він помітив, що фоторецептор не є однорідним, але поділений на сегменти — зовнішній та внутрішній. Відповідно до морфології зовнішніх сегментів фоторецепторів, Шульце їх назвав Stäbchen (паличками) та Zapfen (колбочками.) У паличках Шульце виділив довгі, циліндричні зовнішні сегменти; тонкі та видовжені внутрішні сегменти, тоді як в колбочок — короткі, конусоподібні зовнішні сегменти та ширші і сплющені внутрішні сегменти. Крім того, наявність чи відсутність у внутрішньому сегменті фоторецепторів спеціалізованих структур, — «олійних краплин», що притаманні сітківкам птахів та деяких плазунів, — слугувало основою для відокремлення колбочок (які їх мають), від паличок (які позбавлені таких вкраплень).
Чітко виділивши внутрішні та зовнішні сегменти фоторецепторів і їх відмінність між паличками та колбочками, Шульце встановив відмінну роль, яку вони відіграють у процесі зору. Паличкам він відвів роль у безколірному нічному зорі, тоді як колбочки вважав відповідальними за кольоровий денний зір. у порівнянні з більш розвиненими колбочками, палички Шульце вважав більш примітивним органом зору. Він встановив, що найбільша концентрація колбочок знаходиться в центрі сітківки (центральна ямка) людини, тоді як палички переважають на її периферії. Порівнявши свої гістологічні дані із поведінковими відкриттями фізіолога Германа Обера про те, що зі збільшенням відстані від центральної ямки розрізнення кольорів та гострота зору спадають, Шульце прийшов до висновку, що тільки колбочки відповідальні за кольоровий та просторовий зір з високою роздільною здатністю.
Порівняльні дослідження Шульцем сітківок тварин, які вели нічний чи денний спосіб життя, підтвердили його припущення про функціональну відмінність двох типів фоторецепторів. Вивчаючи сітківки нічних тварин (сов, кажанів, кротів, їжаків), Шульце виявив, що вони мають мало чи взагалі не мають колбочок. Так само він виявив лише невелику кількість паличок у тварин, найбільш активних лише протягом дня (ящірки, змії, хамелеони, деякі види птахів). Оскільки людський зір не розрізняє кольори вночі, Шульце прийшов до загального висновку, що палички відповідальні за безкольорове сприйняття при тьмяному світлі, а колбочки за кольорове сприйняття при яскравому світлі, заклавши основи Duplizitätstheorie («теорії подвійності») зору — відповідно до якої колбочки залучені до денного (фотопічного) зору, а палички до нічного (скотопічного) зору. До сутінкового (мезопічного) зору палички і колбочки залучені разом. Термін Duplizitätstheorie ввів у 1890-х рр. німецький фізіолог та психолог Йоганн фон Кріс
Попри свою новизну та обґрунтованість солідними порівняльними дослідженнями, ідеї Шульце щодо подвійної природи сітківки не отримали одразу належного визнання серед тогочасних фізіологів, а видатний німецький фізіолог Герман фон Гельмгольц навіть не згадав їх у другому виданні свого славнозвісного «Керівництва з фізіологічної оптики» (1896).
Пізніше французький офтальмолог Анрі Паріно незалежно від Шульце прийшов до висновку про існування двох класів фоторецепторів. Він виявив, що така хвороба очей, яка нікталопія (нездатність бачити при тьмяному світлі чи вночі) не призводила до втрати чутливості колбочок в центральній ямці сітківки і встановив, що вона була пов'язана з паличками: пошкодження пігментного епітелію призводило до нічної сліпоти, а оскільки, як було встановлено не задовго перед цим, пігментний епітелій потрібен для регенерації родопсину, який міститься тільки в паличках, то нічний зір спирається на палички. На основі цих відкриттів Паріно висунув ідею «deux retines» (двох сітківок), і припустив як і Шульце, що палички та колбочки виконують різні функції і саме завдяки цьому є можливим денний та нічний зір. Однак подібно до ідей Шульце, ідеї Паріно не привернули уваги колег.
Тільки завдяки німецькому фізіологу Йоганну Крісу, який включив ідеї Мюллера, Шульце та Паріно до власної теорії подвійності (1896) та присвятив їм окремий розділ в редагованому ним третьому виданні «Керівництва з фізіологічної оптики» (1909) Гельмгольца, теорія подвійності зору отримала широке визнання та підтримку серед науковців.
Існування двох відмінних систем фотосприйняття у відповідності з теорією подвійності було також підтверджене психофізично. 1933 р. Стайлс і Кроуфорд виявили парадоксальний феномен: для денного зору світло, яке проходить через периферію зіниці є менш ефективним, ніж світло, яке проходить через її центр (т. зв. «Ефект Стайлса — Кроуфорда», див. нижче). Цей ефект пов'язаний з колбочками, які більш чутливі до світла, що надходить до них вздовж їх осі, аніж під похилим кутом. Однак така чутливість до напрямку світла не проявлялась в нічному зору і не виявлялась для паличок.
1937 р. відомий американський фізіолог Селіг Хегт опублікував ґрунтовний огляд всіх наявних на той час свідчень, які вказували на те, що майже всі вимірювання зорової активності можна розділити на дві частини — 1) рівень низького освітлення, за який відповідають палички і пов'язаний з нічним зором 2) рівень високого освітлення, що спирається на колбочки і пов'язаний з денним зором. На основі аналізу накопичених з часів Мюллера і Шульца даних Хегт прийшов до висновку, що теорія подвійності зору адекватно описує зір і його фоторецепторну природу і повинна слугувати основою для подальших досліджень фоторецепторів.
Теорія трансмутації фоторецепторів
Розрізнення між паличками та колбочками довгий час ґрунтувалось виключно на їх морфології. Хоча таке розрізнення є однозначним для багатьох примітивних та древніх груп хребетних, воно неоднозначне для багатьох груп тварин, що еволюціонували відносно нещодавно і які трансформували свої фоторецептори під час зміни активності в середовищі один раз (напр. геконоподібні) або навіть двічі (деякі змії). Для врахування цих складностей класифікації фоторецепторів американський фізіолог Гордон Волльс запропонував «теорію перетворення (трансмутації)» (1934 р.), відповідно до якої в процесі еволюції тварини трансформували свої фоторецептори для адаптації до нових умов середовища.
Волльс припустив, що палички і колбочки не є відокремленими та незмінними типами рецепторів, але могли еволюціонувати, трансформуючись одне в одне через серію морфологічно різних проміжних ланок. Він вважав, що палички могли заново еволюціонувати із колбочок в тих тварин, що втратили колбочки, і навпаки — палички із колбочок. Перехід плазунів до нічного життя призвів до збільшення розміру зовнішніх сегментів деяких з їх колбочок, внаслідок чого вони поступово ставали паличкоподібними. Як узагальнив основу ідею теорії трансмутації Волльс, «перші палички в світі були генеровані трансмутацією колбочок і цей процес час від часу повторювався, коли потрібно, відтоді, коли хребетні ступили на землю».

Волльс сформулював та розвивав свою теорію вивчаючи морфологію фоторецепторів сітківок представників роду лускатих, зокрема нічних і денних геконоподібних та змій. Він виявив, що сітківки деяких з цих видів мали лише колбочки або лише палички, або ж проміжні фоторецептори (суміш властивостей паличок і колбочок), хоча їх еволюційні пращури мали протилежні сітківки — відповідно, виключно з паличками, або ж виключно з колбочками. Крім того Волльс дослідив, що а) на відміну від денних тварин, фоторецептори в нічних тварин втратили забарвлені олійні краплини чи взагалі не мали таких вкраплень, б) фоторецептори нічних тварин мали більш видовжену форму, із надзвичайно довгими зовнішніми сегментами. Всі ці свідчення трансмутації фоторецепторів різних видів лускатих Волльс виклав у своїй фундаментальній праці «Очі хребетних та їх адаптивна радіація» (1942 р.).
Попри всю радикальність теорії Волльса, вона не суперечила головному аспекту теорії подвійності зору — функціональній відмінності між нічним та денним зором, що спирався на палички та колбочки. Однак теорія трансмутації дозволила по-іншому підійти до вивчення фоторецепторів, їх еволюції та адаптації до середовища і відмовитись від їх трактування, як фіксованих та відокремлених класів фотосприйняття. Теорію Волльса пізніше підтримав і розвинув відомий британський герпетолог Гарт Л. Андервуд (Garth L. Underwood, 1919—2002).
Хоча Волльс вивчав тільки морфологічні аспекти трансмутації, він вважав ключовою відмінністю між нічними та денними фоторецепторами наявність паличкового зорового пігменту (родопсину, RH1) в адаптованих до темряви паличках та його відсутність в колбочках. Не знайшовши паличкового родопсину в сітківках різних представників нічних та денних полозових змій, Волльс припустив, що нічні полозові із винятково паличковими сітківками еволюціонували від денних полозових із винятково колбочковими сітківками. Однак він не мав достатніх даних для підтвердження цієї теорії трансмутації, оскільки в його час не було засобів, потрібних для ідентифікації зорових пігментів, що є молекулярними ознаками різних типів фоторецепторів.
За винятком робіт Волльса та Андервуда, попри прогрес молекулярної біології, теорія трансмутації не отримала належної уваги дослідників, які вивчали головним чином молекулярні складові фоторецепторів птахів, риб та ссавців. Винятком було дослідження фоторецепторів геконів, в яких було виявлено пігменти та диски зовнішніх сегментів, які зазвичай присутні в колбочках, і яким була притаманна експресія генів опсину, пов'язаного із денним зором, незалежно від того чи це нічні види геконів, із винятково паличковими сітківками, чи денні, із винятково колбочковими сітківками.
Волльс також припустив, що фоторецептори «простих сітківок» (з виключно одним типом рецепторів) також є результатом трансмутації. Однак вивчення фоторецепторів змій в контексті теорії трансмутації розпочалось лише в 1990-х рр. і також спочатку стосувалось вивчення лише морфологічних відмінностей. В сітківці звичайної котячої змії було виявлено, що паличкові фоторецептори мають дещо конусоподібний (як у колбочок) зовнішній сегмент та невіддільність дисків зовнішніх сегментів від плазматичної мембрани, що є характерним для колбочок. Це свідчило про те, що такі палички є трансмутованими паличкоподібними колбочками.

Застосування молекулярних технік (імуномаркування зовнішніми раманівськими мітками) та мікроспектрофотометрії для дослідження зорових пігментів винятково паличкової сітківки нічного вужа, виявило в них колбочкові пігменти. Ці дані підтвердили морфологічні дослідження та припущення Волльса, який вважав, що сітківка цього виду має сильно трансмутовані паличкоподібні колбочки.

Лабораторія еволюційного біолога Белінди Чанг (англ. Belinda Chang) з Торонтського університету сьогодні є однією з провідних у світі з вивчення молекулярних складових фотосприйняття та їх еволюції і відома рядом відкриттів, які підтримують та поглиблюють теорію трансмутації Волльса. Використавши широкий спектр технік (секвенування ДНК, філогенетичний та молекулярно-еволюційний аналіз, експресію фотопігментів in vitro, мікроспект-рофотометрію, електронну мікроскопію та імуногістохімію) для дослідження сітківки денної підв'язкової змії західної, яка має один тип подвійних і три типи одиничних колбочок, Чанг з колегами виявили, що деяким малим одиничним колбочкам притаманні паличкоподібні диски зовнішніх сегментів, відмінні від колбочок еліпсоїди внутрішніх сегментів та експресія гену паличкових родопсину (Rh1) і трансдуцину (Gt). Відтак, ці малі одиничні колбочки не є справжніми колбочками, а трансмутованими паличками, що є першим прямим свідченням трансмутації в сітківці змій та першим молекулярним свідченням трансмутації від палички до колбочки.
На основі отриманих даних Чанг з колегами припустили, що винятково колбочкові сітківки еволюціонували не шляхом втрати паличок, а, як припускав Волльс, через еволюційну трансмутацію давніх паличок в колбочко-подібні фоторецептори для того, щоб повернути потрібну для денного життя спектральну чутливість та розрізнення кольорів, втрачені разом з опсинами (SWS2 та RH2) «зелених» колбочок протягом ранньої, можливо землерийної, еволюції змій.
Схожі результати були отримані лабораторією Чанг при вивченні винятково колбочкової сітківки денної соснової змії чорно-білої, в зовнішніх сегментах колбочок яких було виявлено експресію гену паличкового родопсину (Rh1), який однак, знебарвлювався за присутності гідроксиламіну, що характерно для опсинів колбочок. Результати Чанг та колег однозначно вказують на трансмутацію колбочок соснової змії із паличок, що, в цілому, може свідчити про поширеність феномену трансмутацій серед полозових змій.
Теорія трансмутації Волльса знайшла також підтримку в нещодавньому молекулярно-філогенетичному дослідженні цілого ряду полозових змій, в чиїх винятково-паличкових та винятково колбочкових сітківках була виявлена експресія генів колбочокових та паличкових опсинів, відповідно. Хоча отримані результати цього дослідження свідчать про дещо складніший сценарій, ніж припускав Волльс: паличкоподібні колбочки та колбочкоподібні палички змій могли еволюціонувати щонайменше двічі.
У поєднанні із результатами досліджень сітківок геконів дослідження змій припускають, що на відміну від сталої подвійної сітківки риб, птахів та ссавців, фоторецептори плазунів зазнавали повторюваних і радикальних змін.
Зоровий пігмент
Чутливість фоторецепторів до світла обумовлюється спектром поглинання їх зорових пігментів (фотопігментів), що знаходяться в зовнішньому сегменті фоторецептору.
Відкриття зорового пігменту
Зорові пігменти відкрив в 1876-77-х рр. німецький фізіолог Франц Болл, вивчаючи сітківку жаб. Він виявив, що вплив світла на сітківку призводить до знебарвлення її червонувато-пурпурового кольору, роблячи її блідою. Однак Болл помітив, що сітківка відновлює свій пурпуровий колір, якщо тварина тримається в темряві після впливу світла. На основі цих відкриттів Болл прийшов до висновку, що світло призводить до знебарвлення пігменту сітківки і припустив, що в зовнішніх сегментах паличок наявні субстанції, що реагують на світло і передають цю інформацію до ЦНС через фотохімічний процес.
В кінці 1870-х рр. німецький фізіолог Вільгельм Кюне підтвердив відкриття Болла, показавши, що зоровий пігмент паличок жаби знебарвлюється під впливом світла, але відновлює свій колір в темряві і зберігає його навіть після смерті. Через характерний колір він назвав фотопігмент палички «зоровим пурпуром» (нім. Sehpurpur); сьогодні він відомий як родопсин. Кюне також виявив, що відновлення фотопігменту після знебарвлення пов'язане із пігментним епітелієм сітківки, за відсутності якого родопсин не повертається до первинного передзнебарвленого стану. Крім того, Кюне вперше виміряв спектральну чутливість родопсину й прийшов до висновку, що зорове сприйняття спирається на поглинання світла цим пігментом.
В 1930-х рр. видатний американський фізіолог Джордж Уолд показав, що родопсин під впливом світла розкладається на каротиноїд, який він назвав «ретинен» (англ. retinene, сьогодні відомий як ретиналь) і білок (пізніше названий опсином). Уолд прийшов до висновку, що зоровий пігмент є складним білком із ретиненом, як простетична група. Крім того, Уолд розпочав вивчення фотопігментів колбочок і вилучив із сітківки курки чутливий до червоного світла пігмент, який назвав «йодопсин» , — назва, яку він переніс на всі фотопігменти колбочок, аби відрізнити їх від фотопігменту палички, родопсину. Уолд з колегами показав, що йодопсин знебарвлюється, формуючи ретиналь та білок, який є відмінним від білка опсину в родопсині.
В середині 1950-х рр., в серії статей Уолд з колегами показали, що система родопсину залежить від ізомеризації ретиналю (конформаційної зміни в молекулі) і що 11-цис-ізомер ретиналю є попередником всіх зорових пігментів.
Використавши рідкий азот для уповільнення хімічних процесів, Уолд та ін. вперше показав, що родопсин проходить через серію нестійких молекулярних перетворень, одне з яких (метародопсин ІІ) приводить до збудження фоторецептору перш ніж ретиналь буде гідролізований з опсину.
За свої відкриття пов'язані з фотохімією зору Джордж Уолд отримав в 1967 р. Нобелівську премію з фізіології або медицини.
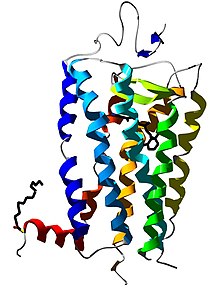
Структура зорового пігменту
Всі зорові пігменти мають однакову структуру, складаючись із білка опсину та світлопоглинаючого хромофора, ретиналю (альдегід вітаміну A1), що ковалентно зв'язаний з опсином через основи Шиффа і надає білку його колір. Саме хромофор робить фотопігменти чутливим до світла.
Опсини — це трансмембранні семиспіральні білки (належать до G-білок-спряжених рецепторів), єдиний поліпептидний ланцюг яких складається з 364 (гени фотопігменту M- та L-колбочок) або 348 (ген фотопігменту S-колбочки та родопсину) амінокислотних залишків. Близько 50 % опсину розміщено всередині біліпідної мембрани, а два кінці його амінокислотного ланцюжка (C-кінець та N-кінець), як і короткі білкові петлі, що з'єднуються з альфа-спіраллю, знаходяться поза мембраною.
Хромофор — це група атомів в молекулі, що найбільш сильно залучена до поглинання випромінювання. Так, подвійний зв'язок між атомами вуглецю (C=C) діє як хромофор внаслідок оптичного збудження одного з електронів, що формують подвійний зв'язок (т. зв. π-зв'язок), в незв'язувальну π*-орбіталь (перехід від π до π*). Тож активність хромофору є наслідком переходу π-до-π*. Такий електронний перехід здійснюється після поглинання ультрафіолетового випромінювання. Коли ж подвійний зв'язок C=C є частиною лінійного ланцюга кон'югованих атомів вуглецю (-С=С-С=С-), то спектр поглинання π,π* зміщується до довших довжин хвиль, до видимого діапазону спектру.
Поєднуючись із хромофорами, опсини формують світлочутливі комплекси фоторецепторів. Майже всі відомі опсини як хромофор використовують все-транс- і 11-цис-форми ретиналю — полієнового ланцюга із 6 кон'югованими подвійними зв'язками. Один кінець полієнового ланцюга ковалентно зв'язаний із залишком лізину через протоновані основи Шиффа, тоді як інший кінець формує до β-іононове кільце.
11-цис-ретиналь функціонує як зворотний агоніст, придушуючи активність G-білка; тоді як все-транс-ретиналь діє як агоніст, що запускає формування активного стану опсину. Поглинання фотону 11-цис-ретиналем є початком зору, після чого через близько пікосекунди ретиналь ізомеризується до все-транс-ретиналю, приводячи до конформаційної зміни опсину, запускаючи сигнальний біохімічний каскад, наслідком якого є зміна мембранного потенціалу фоторецептора, що змінює вивільнення нейромедіатора синапсами і сигналізує нейронам другого порядку про світловий стимул.
Відмінність в первинній структурі (точній послідовності амінокислот) опсинів визначає спектральну відмінність між фотопігментами. Знаючи положення амінокислоти в одному фотопігменті можливо визначити їх відповідне положення у фотопігменті інших типів фоторецепторів. Як правило, для фотопігментів людини щоб виявити положення амінокислот в S-опсині яке відповідає даному положенню в родопсині віднімають 3, або додають 16 для виявлення відповідного положення в L- і M-опсинах.
В опсинах хребетних існує кілька консервативних амінокислотних залишків, які відіграють важливу структурну та функціональну роль для фотопігментів. Так, ϵ-аміногрупа залишку лізину в сьомому трансмембранному домені (положення 296, Lys296) формує протоновану основу Шиффа із альдегідною частиною ретиналю, утворюючи зв'язок між опсином та 11-цис-ретиналь хромофором. Залишок глутамінової кислоти в положенні 113 (Glu113) діє як протиіон для основи Шиффа, нейтралізуючи позитивний заряд цього альдимінного зв'язку (див. нижче). Залишок проліну в положенні 291 є важливим для утримання опсинної кишені зв'язування для хромофора. А два залишки цистеїну (положення 110 та 187) формують дисульфідний зв'язок, що є ключовим для належного згортання фотопігменту. Розрив цього зв'язку призводить до повної втрати фотопігментом його функції і, як наслідок, до пігментного ретиніту якщо це фотопігмент палички, або ж сліпоти щодо червоних/зелених кольорів, якщо це L- або M-фотопігмент.
Класи фотопігментів
Зорові пігменти фоторецепторів класифікуються відповідно до спектра поглинання фотонів, що описує відносну ймовірність поглинання фотона з певною енергією. Існує кілька класів фоторецепторів, кожен з яких має характерний спектр поглинання з піком у найбільш переважній довжині хвилі світла.
В паличках та колбочках виявлені п'ять різних типів зорових пігментів: тип Родопсин 1 (позначається: Rh1) найчастіше знаходиться в паличках і має максимальну чутливість (λmax) 482—508 нм (діапазон «синьо-зеленого» світла), тоді як в колбочках знаходяться інші чотири типи пігментів: Rh2, LWS (англ. long wavelength sensitive, чутливі до довгих довжин хвиль світла), із λmax 500—570 нм («червоне/зелене» світло); MWS (англ. mid wavelength sensitive ; чутливі до середніх довжин хвиль світла) із λmax 480—530 нм («зелене» світло), SWS1 і SWS2 (англ. short wavelength sensitive; чутливі до коротких довжин хвиль із λmax 355—445 нм («ультрафіолет/фіолетове» світло)) і 400—470 нм («синє» світло), відповідно..
Зорові пігменти хребетних еволюціонували близько 500 млн років тому і походять із п'яти класів генів опсину: чотири спектрально відмінні класи генів опсину колбочок та один клас опсину палички. Опсинні класи колбочок еволюціонували через дуплікацію генів, а клас опсину палички Rh1 еволюціонував скоріш за все через дуплікацію гену Rh2-опсину колбочки, з яким він має найбільшу схожість нуклеотидної послідовності.
Нічний спосіб життя ранніх ссавців призвів до зменшення кількості класів генів зорових пігментів колбочок із чотирьох до двох. А деякі одноколірні нічні та морські види потім втратили і один з цих двох класів генів. Тому триколірність деяких приматів і людини пов'язана або з дуплікацією одного з цих двох класів генів або з поліморфізмом. На відміну від ссавців, птахи зберегли гени чотирьох фотопігментів колбочок, чия експресія присутня в їх одиничних та подвійних колбочках. Однак, як птахи, так і більшість ссавців втратили чутливість до ультрафіолетового світла, яка присутня лише в кількох видів ссавців (гризуни та сумчасті), тоді як у птахів вона заново набута.
Адаптація тварин до нових умов призводить до змін чутливості класів зорових пігментів, які по-різному налаштовуються до конкретних спектральних областей чи нових зорових завдань. Мутація в гені опсину може призвести до спектрального зміщення максимальної чутливості фотопігменту, бо навіть заміна одного нуклеотиду може викликати заміщення ключової амінокислоти, що змінить взаємодію між хрофомором та опсином.
Генетичне кодування фотопігменту
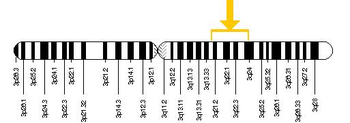
У ссавців окремі гени кодують кожен з опсинів в паличках та колбочках, але їх структура та довжина різниться між видами. В людей довжина гену (на 3 хромосомі) який кодує родопсин 5,0 кб, тоді як ген (на 7 хромосомі), що кодує S-опсин, має довжину 3,2 кб.
Гени родопсину та S-опсину мають чотири інтрони та п'ять екзонів. Внаслідок аутосомного розміщення в людини зазвичай наявні дві копії кожного із цих генів. Тільки гени L/M-опсинів розміщені на X-хромосомі. Більшість ссавців мають тільки один L/М-ген на X-хромосомі і лише більшість мавпових (в тім числі люди) мають два L- і M-гени.
В приматів, чиї обидва L- і M-гени знаходяться на одній X-хромосомі, вони розміщені в тандемних масивах біля кінця довгого плеча цієї хромосоми (Xq28). Подібна організація постала внаслідок дуплікації генів, яка за підрахунками відбулась 35 млн років тому. L- та M-гени кожен містять п'ять інтронів та шість ексонів і мають довжину 13,1 кб. Більшість людей мають інтрон 1 розміром 2 кб в гені L-пігменту, однак у ~35 % афро-американців відсутній цей інтрон, а менше ніж 1 % європеоїдів мають коротший ген L-пігменту.
Розміщення генів M та L-пігментів на X-хромосомі обумовлює більшу частину кольорової (зелений-червоний) зорової нестачі в чоловіків, які мають лише одну X-хромосому у порівнянні з жінками. Організація по типу «голова до хвоста» генів L- та M-фотопігментів на Х-хромосомі та схожість їх нуклеотидної послідовності означає, що ця ділянка хромосоми вразлива до порушення спарювання протягом мейозу, що призводить до нерівного кросинговеру між масивами генів. У випадку перехрещення між генами відбувається видалення гену з однієї хромосоми та її перенесення на іншу, тоді як перехрещення в самому гені призведе до появи гібридного гена, що поєднує ділянки L та M генів в єдиний ген. Вважається, що саме такі гібридні гени є генетичною основою більшості з дефектів кольорового зору.
На білковому рівні родопсин людини на ~41 % гомологічний з S-, M- та L-опсинами. Тоді як гени L- та M-пігментів гомологічні на 96 %, відрізняючись лише 15 амінокислотами, але тільки на 43 % вони гомологічні із S-пігментом. Заміщення в цих положеннях амінокислот пояснює спектральну відмінність (λmax) в 30 нм між L та M фотопігментами, яка обмежена ексонами 2 — 5. Найбільше спектральне зміщення (15-25 нм) між L та M пігментами пов'язане з відмінностями в амінокислотних положеннях, що кодуються ексоном 5: положення 277 (~7 нм) та 285 (~14 нм). Заміна в сайтах в ексонах 2 — 4 призводить до значно менших спектральних зміщень (~4 нм) і може бути пов'язана із рідкісними відмінностями між аномальним та нормальним кольоровим зором.
Висока гомологія між генами L- та M-пігментів вказує на їх походження від одного гена. Порівняння послідовностей амінокислот також свідчить про те, що S-колбочки та палички постали з одного спільного фоторецептора. Тоді як порівняння із сучасними мавпами Нового Світу, які мають тільки два фотопігменти, вказують на дуплікацію та дивергенцію гену довгохвильового фотопігменту, внаслідок чого постали L- та M-фотопігменти, коли мавпи Старого Світу відокремились від мавп Нового світу.
Спектральна чутливість фотопігменту
Стохастичність поглинання фотонів
Світло — це електромагнітна хвиля видимого спектра (в діапазоні частот 4×1014 — 7,5×1014Гц, що відповідає довжинам хвилі в діапазоні 400—750 нм). Електромагнітна хвиля складається зі швидко змінюваних електричного та магнітного полів, що розповсюджуються в просторі. Вона має частоту (ν) та густину енергії, що є пропорційною квадрату електричного поля. Енергія електромагнітного поля передається об'єктам, як дискретні кванти, фотони. Величина енергії, яку фотон може передати об'єкту, пропорційна його частоті.
Випромінювання та поглинання фотонів є стохастичним процесом, що адекватно може бути описаний як простий пуассонівський процес. Відтак, ймовірність того, що дане число фотонів буде поглинуте або випромінене у фіксований проміжок час над фіксованою площею описується пуассонівською густиною:
де k — число поглинених фотонів, а — середнє число поглинених/випромінених фотонів у фіксований проміжок час над фіксованою площею. Число випромінених фотонів пропорційне яскравості світла, однак точний час і місце появи одиничного фотона є невизначеним, тому можуть бути передбачене лише статистично, що покладає фундаментальні фізичні обмеження на можливості зору. Фотонна статистика зображення на сітківці накладає верхню межу на вірогідність будь-якого рішення, що базується на цьому зображенні. Відтак, вже на рівні фоторецепторів проблема зору постає як статистична проблема.
Спектр дії фотопігменту
Першим кроком у процесі зору є поглинання фотонів зоровими пігментами фоторецепторів, що запускає складний біохімічний каскад фототрансдукції. Відтак, існує тісна узгодженість між відносною спектральною чутливістю фоторецептора (його «спектром дії») та спектром поглинання його фотопігменту.
Тільки фотони, що поглинаються зоровими пігментами, будуть залучені до процесу зору і жоден із пострецепторних нейронних механізмів обробки інформації не в змозі відновити чи замінити інформацію, втрачену коли фотони не були поглинуті. Тому фотохімічні властивості зорових пігментів накладають фундаментальні обмеження на ймовірність схоплення фотонів фоторецепторами, а, відтак, і на зорове сприйняття світу.
Оскільки поглинання фотонів є стохастичним процесом, то сигналізування фоторецептором схоплення фотону визначається головним чином ймовірністю поглинання фотону, що є функцією частоти фотону. Позаяк частота є фундаментальною властивістю фотону, то спектральне поглинання зоровим пігментом повинно виражатись, як функція частоти. Втім, загальноприйнятим є визначення спектрального поглинання як функції довжини хвилі, припускаючи, що воно стосується фотону у вакуумі. Хоча коли електромагнітна хвиля поширюється в середовищах з різним показниками заломлення, то довжина хвилі змінюється пропорційно швидкості світла, а зберігається тільки її частота. Тому для поглинання зоровим пігментом ключовою є енергія фотону, а не його довжина хвилі. До прикладу, хоча довжина хвилі «зеленого» фотону в середині ока залежить від того, чи заповнене воно водою або повітрям, проте саме сприйняття фотону не змінюється, оскільки поглинання світла фоторецептором залежить від енергії фотонів, що пропорційна його незмінній частоті.
Якщо розглядати спектральне поглинання фотопігменту як функцію довжини хвилі, то спектри поглинання зорових пігментів всіх видів хребетних є схожими, складаючись з кількох відмінних діапазонів поглинання: α-, β-, γ-діапазони та ін.. Головний, α-діапазон, разом зі значно слабшим (β-діапазоном), пов'язаний із опсин-зв'язаним хромофором і формує асиметричну та куполоподібну криву, що описує відносну ймовірність поглинання кожної з довжин хвиль світла (енергії фотону). Піком α-діапазону є довжина хвилі світла, що поглинається з найвищою ймовірністю, відома як λmax (довжина хвилі максимального поглинання). Лише зв'язування опсину з ретиналем формує широкий, α-діапазон поглинання у видимому спектрі світла. λmax α-діапазону даного фотопігменту залежить від генетично обумовленої послідовності амінокислот опсину та взаємодії конкретного опсину з хромофором. Другий, значно менший, діапазон поглинальної здатності (β-діапазон) пов'язаний із цис-діапазоном хромофору. Зростання спектрів фотопігменту L- та M-колбочок при дуже коротких довжинах хвиль є свідченням такого β-діапазону.
Існують відповідні шаблони, які дозволяють моделювати повне спектральне поглинання зорового пігменту використовуючи тільки довжину хвилі його максимального поглинання, λmax. Найбільш поширеним серед яких є шаблони зорових пігментів, отримані В.Говардовським та ін.
Опсинне зміщення
Оскільки всі зорові пігменти ссавців містять один і той же хромофор (11-цис-ретиналь), а їх λmax коливається в діапазоні від ~360 нм в ближній УФ-області спектру (миші та морські свинки) до ~565 нм в червоній області спектру (примати і люди), то різниця в λmax між різними типами фотопігментів обумовлена послідовністю амінокислот опсину та взаємодією специфічних амінокислот із хромофором в ділянці зв'язування опсину. Зокрема, обмежене число положень амінокислот в молекулі опсину відіграють ключові ролі в спектральному налаштуванні фотопігменту, що узгоджується з психофізично-електрофізіологічними вимірюваннями, які виявили групування значень λmax фотопігментів в дискретних спектральних положеннях.
Самі по собі опсини максимально поглинають фотони в ультрафіолетовій області спектру, нижче 300 нм, тоді як хромофор 11-цис-ретиналь максимально поглинає в діапазоні ~380 нм. Протонування основи Шиффа 11-цис-ретиналю в органічному розчиннику (метанол) зміщує λmax із 380 до ~440 нм. Однак, напр. в бичачому родопсині, в якому 11-цис-ретиналь ковалентно зв'язаний із залишком лізину Lys296, λmax цього самого ретиналю зміщується до 498 нм, тобто відбувається червоне зміщення на 58 нм. Таке саме зміщення λmax хромофору також відбувається в колбочкових фотопігментах. Зміщення λmax між пігментом та протонованою шиффовою основою хромофору називається «опсинним зміщенням», оскільки білок опсину змінює спектр поглинання пігменту у порівнянні з протонованою основою Шиффа 11-цис-ретиналю. Терміном «опсинне зміщення» також описується різниця значень λmax серед фотопігментів, позаяк у зорових пігментах з однаковими хромофорами відмінність в спектральній чутливості постає з відмінності в послідовностях амінокислот опсину.
Було запропоновано кілька механізмів, як взаємодія хромофор-опсин може спричинити «опсинне зміщення»: 1) зміна сили електростатичної взаємодії між групою протонованої шиффової основи хромофору та його протиіоном чи акцептором водневого зв'язку. 2) розміщення повного або часткового зарядів вздовж полієнового ланцюга. 3) зміна полярності або поляризованості середовища білка опсину.
Найбільш загальноприйнятим поясненням опсинного зміщення є модель «точкового заряду», що регулює λmax шляхом зміни розміщення повних або частково заряджених груп у зв'язувальній кишені хромофору. Зокрема, модель припускає, що якщо один негативний заряд розмістити поблизу протонованої основи Шиффа, а інший негативний заряд на 3Å від C12 та 3,4Å від C14 хромофору, то це призведе до значного червоного зміщення λmax родопсину.
Регулювання спектральної налаштованості фотопігменту
Амінокислотні заміни
В процесі еволюції спектральне налаштування зорових пігментів обумовлювалось мутаціями в амінокислотній послідовності білка опсину, фіксація яких зазвичай відбувається протягом 103−104 поколінь. Щоб такі мутації впливали на електростатичне та стеричне середовище хромофору, а відтак і на енергетичну щілину між основними та збудженими станами хромофору, вони повинні траплятись біля хромофорної кишені. Єдина амінокислотна заміна може змістити λmax на ~75 нм, однак спектральна налаштованість фотопігменту зазвичай реалізується через кілька таких заміщень.
У ссавців ідентифіковано чисельні амінокислотні залишки в молекулі опсину, які впливають на спектральну налаштованість їх фотопігментів. Серед фотопігментів L/М-колбочок було виявлено п'ять положень амінокислот, що відповідальні за спектральну налаштованість: 180, 197, 277, 285, 308. Відмінності лише в трьох положеннях амінокислот (180, 277 та 285) відповідальні за більшу частину зміщення λmax між L- та М-фотопігментами. Більш складною є налаштованість S-фотопігменту. Тоді як для зміщення λmax родопсину від 500 до 440 нм потрібно щонайменше дев'ять положень амінокислот в опсині, то оскільки λmax фотопігменту S-колбочки людини ~420 нм, до цього зміщення повинні бути залучені додаткові положення амінокислот. Інші додаткові положення функціюють разом для зміщення λmax до ще коротших довжин хвиль, обумовлюючи зміщення λmax фотопігментів миші в ультрафіолетовий кінець спектру.
Зміна хромофору
Значно швидша модифікація спектральної чутливості фотопігментів здійснюється через зміну хромофору. Вітамін А має в хребетних дві форми — вітамін А1 і вітамін А2. Вітамін А має в хребетних дві форми — вітамін А1 і вітамін А2. Зорові пігменти, сформовані із ретиналю (альдегід вітаміну А1) називаються родопсинами (поширені серед морських та наземних тварин), тоді як пігменти, які містять 3-дегідроретиналь (похідний вітаміну А2) називаються порфиропсинами (поширені серед риб, земноводних, плазунів).
Хромофор, що знаходиться в гідрофільній зв'язувальній кишені в середині опсину, складається із кон'югованого ланцюга із 18 атомів вуглецю, прикріплених до β-іононового кільця, а 3-дегідроретиналь ще містить додатковий подвійний зв'язок між вуглецями в β-іононовому кільці. Тому з'єднання 3-дегідроретиналю з опсином зміщує λmax зорових пігментів до довших довжин хвиль і А2-пігменти варіюються в діапазоні від 400 до 635 нм, однак за рахунок зменшення теплової стабільності та фоточутливості. Таке зміщення залежить від довжини хвилі, досягаючи 50-60 нм із зоровими пігментами, чутливими до довгих хвиль (LWS) і лише кілька нанометрів з короткохвильовими пігментами (SWS1, SWS2).

Оскільки А2-хромофор характеризується більшим тепловим шумом при температурі 35-40 °C, то хромофорне зміщення від А1 до А2 є недоступним для теплокровних хребетних (ссавців та птахів). Однак багатьом земноводним та рибам притаманне хромофорне зміщення між А1 та А2, що пов'язане із порою року та періодом розвитку. Так, протягом метаморфоз із пуголовка у бурої жаби відбувається зміщення від А2 до А1, тоді як шпоркова жаба бувши пуголовком має суміш А1 і А2 хромофору, що потім з розвитком змінюється на А2. Багато риб (напр., лосось) змінюють А1 на А2 хромофор коли мігрують з океану до річки для метання ікри. В цілому, морські види риб використовують А1-хромофор, а прісноводні види — А2-хромофор, що корелює зі спектральними відмінностями в цих середовищах.
Існує також багато тварин, які мають одночасно А1 і А2-хромофор, як північноамериканська велика зелена жаба. Цей вид жаб має А2-хромофор на дорсальному кінці сітківки та А1 у її вентральній частині, співвідношення яких залежить від пори року. Одночасна присутність двох хромофорів корелює з двома полями зору цієї жаби, що знаходиться на поверхні води ставка: підводне поле зору спрямоване на дорсальну частину сітківки, а надводне поле зору на вентральну частину.
Отож, шляхом лише зміни хромофорів в процесі розвитку чи сезонних змін, зорові пігменти можуть істотно змінювати максимальну спектральну чутливість, приводячи до змін кольорового зору.
Крім того, спектр поглинання фотопігменту обумовлюється концентрацію пігменту в зовнішньому сегменті фоторецептора та довжиною зовнішніх сегментів. Ці чинники впливають на спектр поглинання через т. зв. ефекти самоекранування (див. детальніше ефект самоекранування). Позаяк зоровий пігмент знаходиться в мембранних дисках, що формують шари в зовнішньому сегменті фоторецептору, то перший шар фотопігменту поглинає більше світла із довжинами хвиль, близькими до його довжини хвилі максимального поглинання, λmax. Тому світло, яке досягає другого шару містить менше фотонів із довжинами хвиль, близькими до λmax (перший шар екранує другий шар) і цей шар поглине менше світла з λmax, а більше світла з «не максимальними» довжинами хвиль. Таке самоекранування далі поширюється на всі інші шари фотопігменту в зовнішньому сегменті, роблячи загальний спектр поглинання фоторецептора тим ширшим, чим більше шарів світло повинно пройти.
Протонування основи Шиффа
Всі зорові пігменти мають залишок лізину (в паличці бика знаходиться в положенні 296; в L-колбочці людини — 312), розміщеного в сьомому трансмембранному сегменті й ковалентно зв'язаному з хромофором ретиналем через основи Шиффа (ОШ). У фотопігментах, які поглинають видиме світло (λmax > 380 нм), основа Шиффа є протонованою, що призводить до делокалізації π-електрону в системі кон'югованих подвійних зв'язків ОШ ретиналю, в такий спосіб уможливлюючи поглинання видимого світла. У фотопігментах хребетних позитивно заряджена, протонована ОШ стабілізується негативно зарядженою глутаміновою кислотою в положенні 113 (Glu113), яка тому називається протиіоном (іон з протилежним зарядом).
Делокалізація позитивного заряду до протонованої основи Шиффа впливає на спектральну чутливість фотопігменту: збільшення степені делокалізації призводить до довгохвильового (червоного) зміщення, а зменшення — до зміщення в бік коротких довжин хвиль (синє зміщення). Така зміна розподілу заряду вздовж хромофору здійснюється через взаємодії між диполярними амінокислотними залишками та хромофором і через модуляцію взаємодії між протиіоном (Glu113) та протонованою шиффовою основою.
Багато птахів, риб, плазунів, земноводних та деяких ссавців мають фотопігменти, чутливі до ультрафіолетового діапазону спектру, з λmax 360—370 нм. Разом з фіолетовими (чи синіми) пігментами, ультрафіолетові пігменти (УФ) з λmax 390—430 нм належать до групи SWS1-пігментів. Порівняння амінокислотних послідовностей різних SWS1-пігментів не виявило жодної спільної амінокислоти поміж УФ-пігментів, що свідчить про те, що спектральна чутливість УФ-пігментів різних видів хребетних обумовлена відмінними механізмами
Втрата в SWS1-пігментах протонування ОШ призводить до їх короткохвильового зміщення λmax в ультрафіолетовий діапазон спектру. В результаті заміни в SWS1 пігменті зарядженого Glu113 незарядженим Gln постає пігмент з pH-чутливою λmax: збільшення pH веде до зміщення λmax з ультрафіолетового (з піком 351 нм) до фіолетового (424 нм). В природному стані чутливих до ультрафіолету SWS1 пігментів ОШ непротоновані, тоді як чутливі до фіолетового спектра SWS1 пігменти є протонованими, що свідчить про вплив протонування ОШ SWS1-пігментів на їх спектральну чутливість.
Для зміни стану протонування ОШ SWS1-пігменту достатньо однієї амінокислотної заміни. Хоча первинно SWS1-пігменти хребетних були чутливі до ультрафіолету, зміщення їх чутливості до фіолетового траплялось багато разів в еволюції і було пов'язане із заміною фенілаланіну (в положенні 86, Phe86) на тирозин (Tyr) або серин (Ser). На відміну від тих хребетних, в яких чутливі до ультрафіолету SWS1 пігменти були первинно, у птахів такі пігменти постали через втрату чутливості до фіолетового діапазону спектру внаслідок амінокислотної заміни Phe86 на Ser. з-поміж всіх вивчених хребетних, лише для пташиних чутливих до ультрафіолету пігментів є характерним зміщення спектральної чутливості назад до фіолетового через заміну Ser (в положенні 90) на цистеїн (Cys). Така амінокислотна заміна свідчить про альтернативний спосіб формування пігменту, чутливого до ультрафіолету і скоріш за все її наслідком є втрата протонування ОШ.
В паличкових пігментах протонування ОШ стабілізується комплексом водневого зв'язку довкола ОШ. Амінокислотні залишки, залучені до цього комплексу ОШ, знаходяться в положенні 94, 113, 181, 186, 192 та 268, і разом з молекулами води відіграють ключову роль в механізмі переключення протиіону ОШ, що відбувається після формування проміжного стану метародопсину І (МІ) внаслідок активації родопсину поглинанням світла.
Колір та довжина хвиль світла
Довжини електромагнітних хвиль (λ), які є видимими для людини (можуть пройти через оптику ока та спричинитись до фотохімічної зміни в зорових пігментах сітківки), знаходяться в діапазоні від 400 нм (фіолетовий) до 700 нм (темно-червоний). Цей діапазон видимого світла включає кольори спектру, які Ісаак Ньютон описав як червоний, помаранчевий, жовтий, зелений, блакитний, індиго та фіолетовий. Для деяких тварин, включаючи риб, птахів та багатьох членистоногих, цей спектр розширюється до ультрафіолетового діапазону — від 400 до ~320 нм (ультрафіолет А, UVA).
Об'єкти в зовнішньому світі відбивають різні довжини хвиль світла по-різному. Тому розподіл довжин хвиль в світлі, відбитому від об'єктів, допомагає тваринам ці об'єкти ідентифікувати, розрізнити та класифікувати. Так, листя відбивають більшість світла в діапазоні 500—600 нм, сині квіти в діапазоні 350—500 нм, стиглий фрукт — 550—600 нм і т. д..
Слід розрізняти колір і довжину хвилі світла. Як відзначав ще Томас Юнг в 1802 р., самі по собі довжини хвиль не мають кольору. Колір, який людина суб'єктивно сприймає, постає як результат аналізу зоровою системою різних довжин хвиль світла.
Коли в 1960-х рр. вперше була виміряна чутливість одиничних колбочок до різних довжин хвиль світла, то було виявлено, що жодна з них не була чутливою до «червоних» довжин хвиль (довших 600 нм). Найближчою до червоного кольору є колбочка, що має максимальну чутливість до довжини хвилі ~564 нм, що відповідає жовто-зеленому кольору. Тому червоний колір не має окремого фоторецептора в сітківці людини, а відображається як зменшення у вихідному сигналі колбочок з λmax = 564 нм та ще більшим зменшенням у вихідному сигналі колбочок з λmax = 534 нм. Відтак, для справжнього «червоного» кольору (довжини хвиль більше ніж 650 нм) зостаються активними тільки колбочки з λmax = 564 нм. Тому приписування суб'єктивного сприйняття певного кольору до довжини хвиль приводить до змішання, коли ми називаємо, до прикладу, довжину хвилі 580 нм як «жовтий» колір. Однак, суб'єктивний жовтий колір постає як поєднання світла з довжинами хвиль 620 нм («червоний» колір) та 540 нм («зелений» колір). Так само є багато кольорів, які людина сприймає як один, але які не мають відповідних одних спектральних довжин хвиль (напр., «пурпуровий» колір є поєднанням довгих (червоний колір) та коротких (синій колір) довжин хвиль).
Принцип уніваріантності
Хоча ймовірність того, що фотон буде поглинений фоторецептором істотно змінюється із довжиною хвилі світла (визначаючи спектральну чутливість фоторецептора), однак, — відповідно до запропонованого в 1960-х рр. англійським фізіологом Вільямом Раштономпринципу уніваріантності, — ефект від поглинання фотону незалежний від довжини хвилі. Тому кожен з трьох класів колбочок, які забезпечують триколірний зір, характеризується уніваріантною (одновимірною) реакцією на поглинений фотон. Уніваріантність полягає в тому, що поглинання фотону одиничним зоровим пігментом постає, як відгук однієї змінної на зміну інтенсивності світла. Відтак, фотопігмент відображає весь спектр видимого світла у вихідний сигнал однієї змінної — частоту (кількість) поглинання квантів світла. Формально, фоторецепторний відгук, R, може бути описаний як функція світла, поглиненого фотопігментом при даній довжині хвилі:
де I — число квантів світла; Aλ — частка падних фотонів, поглинених фотопігментом для кожної довжини хвилі, λ.
В.Раштон відзначав, що коли зоровий пігмент поглинає фотон, то вплив на пігмент буде однаковим, незалежно від довжини хвилі фотону: «Вихідний сигнал фоторецептора залежить від його схоплення кванту [світла], але не від того, які кванти були схоплені». Тому, хоча фотони з довжиною хвилі λ=450 нм мають більше енергії, ніж з λ=750 нм, послідовність реакцій фотопігменту на поглинання фотону з λ=450 нм є такою ж самою, як і послідовність реакцій на фотон з λ=750 нм. Тож, фоторецептор, що є найбільш чутливим до зеленого світла, може генерувати однаковий вихідний нейронний сигнал на стимуляцію тьмяним зеленим або помаранчевим світлом.
Оскільки реакція одиничного фотопігменту не кодує жодної інформації про відносну спектральну складову світла, наш зір не в змозі розрізнити світло з різними спектральними розподілами вночі. Однак уніваріантність не означає, що зоровий пігмент має однакову реакцію на всі світлові спектри, оскільки він максимально чутливий до конкретних довжин хвиль світла, і менш чутливий до інших, що й визначає спектральну чутливість фоторецептора. Але, відповідно до принципу уніваріантності, після поглинання всі кванти світла мають однаковий ефект на фоторецепторний вихідний сигнал.
Тож, фоторецептор постає як складний «лічильник фотонів», зміна вихідного сигналу якого залежить тільки від кількості поглинених фотонів, а вся інформація про енергію фотонів (довжину хвилі) втрачається. Як наслідок, фоторецептори сигналізують нижче розташованим нейронам сітківки та всій вищій зоровій системі лише частоту (кількість) поглинених фотонів, а не їх «кольори» (довжину хвилі). Оскільки зміна в частоті поглинання фотону зоровим пігментом може бути результатом або зміни довжини хвилі фотону, або зміни кількості падних фотонів (інтенсивності), то із вихідного сигналу одного фоторецептора нижчестоячі нейрони сітківки не в змозі визначити, чи варіація в частоті є наслідком зміни інтенсивності світла чи довжини хвилі. Через таке змішання кольору та інтенсивності, одиничні фоторецептори, — як палички, так і колбочки,- є «сліпими» до кольору.
Тому, відповідно до принципу уніваріантності, здатність сприймати колір (розрізнення на основі довжин хвиль) можлива тільки завдяки порівнянню нейронами сітківки та вищої зорової системи вихідних сигналів більше ніж одного типу фоторецепторів, що мають відмінні спектральні чутливості. Подібне порівняння можливе завдяки існуванню хроматичних пострецепторних нейронних шляхів, які розрізняють сигнали з різних типів колбочок (напр., L-M та [L+M]-S).
Фотопігменти триколірного зору
Світло змінюється як в інтенсивності, так і довжині хвилі. Кольоровий зір є здатністю розрізнити між двома світловими стимулами на основі довжини хвилі світла, незалежно від його інтенсивності.
Існують дві головні фізіологічні передумови для кольорового зору. Першою є наявність щонайменше двох типів зорових пігментів з відмінними спектральними чутливостями, λmax, які найчастіше притаманні двом різним колбочкам. Тільки за цієї умови спектральні кольори з різними довжинами хвиль дадуть різні співвідношення стимуляції двох фотопігментів, незалежно від загальної стимуляції (всього рівня освітлення). Іншою передумовою кольорового зору є здатність порівняти відносне збудження колбочок, що здійснюється на різних рівнях зорової (пострецепторної) системи.
Наявність кольорового зору припускає, що спостерігач може залучати не тільки довжини хвиль, які відповідають максимальній чутливості (λmax) зорових пігментів, але й проміжні довжини хвиль світла, як і комбінації різних довжин хвиль, через використання співвідношень стимуляції відмінних фотопігментів у різних фоторецепторах.
Розмірність кольорового зору може бути визначена за допомогою методу «узгодження кольорів» (англ. color matching) — визначення з допомогою психофізичних вимірювань кількість світла з фіксованою спектральною складовою (т. зв. «основними кольорами»), кожна незалежно змінювана в інтенсивності, які необхідні для поставлення у відповідність будь-яке спектральне світло. Кількість спектрально відмінних типів фоторецепторів невід'ємно пов'язана з розмірністю кольорового зору, оскільки не може бути менше типів фоторецепторів, аніж існує вимірів кольорового зору.
Кольоровий зір людей, які в нормі мають три типи колбочок, є триколірним. Це означає, що будь-яке видиме світло може бути підігнане (англ. matched) через відповідне змішання лише трьох незалежних «основних кольорів»: червоного, зеленого і синього (незалежних означає, що жоден з трьох основних кольорів не може бути отриманий через поєднання двох інших основних кольорів). Така підігнаність (описувана функціями кольорової відповідності) трапляється тоді, коли відгуки на світло та основні кольори еквівалентні для кожного класу колбочок. Такі кольори, що є фізично різними (мають різний спектральний склад), але сприймаються як однакові, відомі як метамери (напр., відповідність між спектральним жовтим кольором та сумішшю спектральних червоного та зеленого кольорів).
Якщо активним є тільки один тип фоторецепторів, то в такому випадку зір буде одноколірним (монохроматним), тобто зведеним до одного виміру: два світла з будь-якою спектральною складовою можуть бути поставлені у точну відповідність одне одному через просте зіставлення їх інтесивностей. Подібна одноколірність характерна для зору більшості спостерігачів за нічних умов (при тьмяному світла), коли активними є тільки палички. У рідкісних випадках деякі люди є одноколірними й за умов яскравого денного освітлення, оскільки позбавлені колбочок (т. зв. «паличкова одноколірність») або мають тільки один з трьох типів колбочок («колбочкова одноколірність»). Зір є двоколірним (дихроматним), тобто зводиться до двох вимірів, коли активними є тільки два типи колбочок: світло з будь-якою спектральною складовою можна підігнати через поєднання двох інших світлових спектрів. Людей з двоколірним зором, залежно від того, який з трьох типів колбочок у них відсутній, прийнято розділяти на три класи: протанопи (відсутні L-колбочки), дейтеранопи (відсутні M-колбочки) і тританопи (відсутні S-колбочки). Більшість людей з нормальним кольоровим зором мають три класи колбочок і тому є триколірними (трихроматами), тобто мають три виміри кольорового зору.
Структура фоторецепторів

Морфологія та фізіологія фоторецепторів підсилює їх функцію, як світлочутливих клітин. Палички і колбочки є видовженими клітинами із сильно вираженою полярністю, які складаються із п'яти головних компонентів: зовнішній сегмент (ЗС), внутрішній сегмент (ВС), з'єднувального війка (ЗВ), ядра та синаптичного термінала. ЗС локалізований на зовнішній або дистальній частині сітківці, в ньому схоплюються фотони та відбувається його перетворення в електричний сигнал в процесі фототрансдукції. ВС локалізований більш проксимально в сітківці і знаходиться під ЗС; в ньому містяться органели, відповідальні за синтез білків (комплекс Ґольджі та ендоплазматичний ретикулум) та регуляцію метаболічної активності (мітохондрія) клітини. Синаптичний термінал утворює контакт із цільовим нейроном фоторецептора. З'єднувальні війки сполучають ЗС із ВС, забезпечуючи перехід білків із ВС до ЗС.
Світло, після проходження шару нейронів у внутрішній сітківці, надходить до внутрішнього сегмента фоторецептора, звідки спрямовується до зовнішнього сегмента, де взаємодіє з фотопігментом. Реагуючи на світло фоторецептор генерує сигнали які пасивно поширюються вниз по його аксону (~75 мкм в довжину) до синаптичного термінала в зовнішньому плексиформному шарі. Фоторецептор має відмінну від інших нейронів структуру синаптичного термінала, який містить т. зв. синаптичну стрічку, яка сприяє неперервному вивільненню збуджувального нейромедіатора глутамату на нижчестоячі (біполярні та горизонтальні) нейрони.
Зовнішній сегмент
В кожному Фі знаходиться зоровий пігмент, родопсин, який розміщений в стопках мембранних дисків в паличко- та колбочко-подібному зовнішньому сегменті (ЗС) (показник заломлення в паличці — 1,41, в колбочці — 1,39), в якому присутні всі компоненти, потрібні для процесу фототрансдукції.
В 1860-х рр. М.Шульце описав загальну морфологію сітківки жаби та показав, що під впливом світла ЗС паличок розпадались на пластинки. Використовуючи поляризаційний мікроскоп, В.Шмідт в 1930-х рр. зміг показати, що ЗС паличок були двозаломні, вказуючи на те що вони є високовпорядкованими, шаруватими структурами (ламелами), які складаються з ліпідів та білків
В кінці 40-х початку 50-х рр., використовуючи електронний мікроскоп, відомий шведський фізіолог Фіртьоф Сьостранд показав, що ЗС палички морської свинки дійсно були ламелами, чиї поверхні є 75 Å завтовшки.
Подальші дослідження з допомогою електронного мікроскопа показали, що ЗС колбочок і паличок сітківок всіх хребетних складаються з двомембранних дисків (ламел), приблизно 250Å завтовшки, бувши відокремлені одна від одної водою, ферментами та розчинними солями. Товщина кожної з двох мембран диску варіюється від 50 Å до 75 Å.
Циліндричні та конусоподібні зовнішні сегменти
Для паличок характерні циліндричні ЗС, які в ссавців 1,2-2 мкм в діаметрі та 20-40 мкм в довжину, що коливається залежно від часу дня, інтенсивності світла та розміщення в сітківці. Внутрішній об'єм ЗС палички, включно з міждисковим та цитоплазматичним простором, складає 32×10−12мл, тоді як цитоплазма заповнює 10×10−12 мл ЗС. Відтак, цитоплазматичний простір, потрібний для процесу фототрансдукції, заповнює лише ~30 % простору всередині ЗС палички, що свідчить про важливість внутрішніх мембранних структур для фототрансдукції.
Колбочки в сітківці ссавців мають більш циліндричний ЗС, тоді як в не-ссавців для колбочок характерний конусоподібний ЗС, який є коротшим (маючи зазвичай половину довжини ЗС палички) із більшим діаметром в основі, що поступово звужується, набуваючи конусоподібної форми ближче до верхівки. Так, ЗС колбочки миші ~1,2 мкм в діаметрі та 13 мкм в довжині. В центральній ямці сітківки приматів колбочки мають довші ЗС, ~45 мкм.
Структурні відмінності в зовнішньому сегменті між паличками та колбочками обумовлюють і їх функціональні відмінності. Оптика ока спрямовує промені світла вздовж майже прямої лінії від ВС до ЗС і далі вздовж ЗС. У прямих ЗС інтенсивність світла зменшується вздовж їх довжини: молекули зорових пігментів в основі ЗС поглинають фотони, тим самим зменшуючи кількість фотонів, доступних для зорових пігментів на верхівці ЗС, т. зв. ефект самоекранування (див. нижче). Внаслідок хвилевідної природи фоторецептора (див. нижче Фоторецептор, як хвилевід), конусоподібний ЗС зменшує ефект самоекранування, зберігаючи високу інтенсивність світла аж до місця знаходження зорового пігменту. Тому конусоподібний ЗС, поєднаний зі специфічною геометрією ВС, покращує оптичну ефективність колбочок, дозволяючи ВС фокусувати світло на ЗС де воно ефективно взаємодіє з фотопігментом.
Мембранні диски

Палички та колбочки по-різному синтезують мембранні диски ЗС. Диски в ЗС колбочок не відокремлені від плазматичної мембрани, формуючи в ній складки, відкриті до позаклітинного простору, тоді як диски в паличках відокремлені від плазматичної мембрани і закриті від позаклітинного простору бувши відкритими тільки при війчастій основі ЗС
ЗС палички ссавців має складну мембранну структуру, що розділяє цитоплазматичний простір майже на тисячу рівномірно відокремлених функціональних відсіків (дисків), накладених один на один, з відстанню між ними в 30 нм. Кожен диск є закритою структурою, що складається із двох сплюснутих мембран. Такі диски організовують фототрансдукцію в окремі регіони, в яких поглинання одиничних фотонів перетворюється в електричний сигнал.
Відокремлені мембранні диски роблять фототрансдукцію більш ефективною, оскільки білки, залучені в початковий каскад трансдукції світлового сигналу є мембранозв'язаними (родопсин є інтегральним мембранним білком, а трансдуцин та фосфодіестераза прикріплені до мембранних дисків через ліпідні кріплення. Приєднання білків до мембрани підсилює та збільшує швидкість фототрансдукції, позаяк, замість трьох вимірів, дифузія білків обмежується двома.
Наявність великої кількості внутрішніх дисків уможливлює високу концентрацію мембрано-зв'язаних білків в ЗС палички. До прикладу, ЗС палички миші містить ~800 мембранних дисків, що заповнюють 50 % об'єму ЗС, що істотно збільшує ймовірність поглинання фотонів. Складені в стопку мембранні диски збільшують загальну мембранну поверхню в ~1500 разів у порівнянні із самою поверхнею плазматичної мембрани, що уможливлює розміщення величезної кількості зорових пігментів в ЗС.
Молекули родопсину, — яких в ЗС ~140 млн і складають ~80-90 % всіх білків в мембранному диску, — організовані у формі олігомерів вищого порядку і надзвичайно щільно розміщені в дискових ламелах (від 30 до 55 тис. молекул/мкм2, або 108 молекул/паличку). Попри таку щільність, родопсин вільно переміщається в дисковій мембрані, завдяки чому він зустрічає і активує молекули трансдуцину для підсилення світлового сигналу. В ЗС палички миші, що має 24 мкм в довжину і 1,4 мкм в діаметрі, ефективна концентрація родопсину в 3 ммоль збільшує ймовірність поглинання фотона, що проходить через ЗС, до 60 %.
Іншими інтегральними мембранними білками фототрансдукції, які розташовані в дисках ЗС, є дві ізоформигуанілатциклази, RetGC1 та RetGC2, які є трансмембранними білками що перетинають мембрану однократно. Інші білки, що беруть участь у фототрансдукції (трансдуцин, фосфодіестерази 6A, 6B, 6C, 6D, рековерин та білки-активатори гуанілатциклази (БАГЦ)) є периферійнимимембранними білками.
Окрім білків, які беруть участь у фототрансдукції, в ЗС наявні також спеціалізовані білки, які регулюють рух іонів із та в ЗС. Одним із таких білків є добре вивчені цГМФ-регульовані (ЦНР) катіонні канали в плазматичній мембрані ЗС. Через ці канали до ЗС проходять іони Na+ та Ca2+ в адаптованих до темряви паличок і колбочок. У паличок кальцій складає ~10 % «темрявного струму», що переноситься ЦНР-каналами, а в К — ~20 % і більше. В паличках і колбочках Na+ викачується із ВС через натрій-калієвий насос. Такий потік іонів формує основу циркулівного темного струму, більша частина якого переноситься натрієм. Ймовірність відкриття ЦНР каналу, що в свою чергу визначає розмір циркулючого струму, залежить від кількості вільних [цГМФ]. В темряві концентрація вільних [цГМФ] становить 3-4 мкмоль, при якій канал відкривається лише з ймовірністю 0,1-0,2.
В плазматичній мембрані палички втікання Ca2+ через ЦНР канал балансується виведенням Ca2+ з допомогою Na+/Ca2+-K+ білка-обмінника (NCKX), завдяки чому внутрішньоклітинний рівень Ca2+ зберігається на відносно сталому рівні.
Відновлення зовнішніх сегментів
Для підтримки максимальної чутливості фоторецепторів до світла, ЗС відносно швидко відновлюються. До прикладу, в фоторецепторах мишей, щурів та шпоркової жаби гладенької для відновлення ЗС потрібно до 10 днів. Однак відновлення ЗС у жаби леопардової триває понад 6 тижнів.
Синтез нових дисків відбувається в основі ЗС паличок, а старі диски переміщаються до верхівки ЗС, з поверхні якого вони скидаються пачками (від 8 до 30 дисків) і врешті фагоцитуються пігментним епітелієм сітківки. Оскільки ЗС палички містить ~140 млн молекул родопсину, то кожна паличка повинна синтезувати ~10 млн нових молекул родопсину на ЗС щодня, або півмільйона молекул на паличку щогодини.
У колбочках відбувається подібний до паличок процес відновлення ЗС, але оскільки диски колбочок не відокремлені від плазматичної мембрани, відбувається змішання нових та старих компонентів мембранних дисків. Відновлення дисків в колбочках також відбувається через включення нових компонентів та скидання і фагоцитоз частини мембрани ЗС.
Відновлення дисків ЗС відбувається в циркадний спосіб: в паличках синтез нових дисків відбувається перед світанком, а скидання вранці, коли зір перемикається із паличок на колбочки; у колбочок навпаки — скидання дисків перед сутінками, а синтез вранці Крім того, на відміну від паличок, колбочки зберігають їх форму через додаткові утворення складок в напрямку довжини ЗС, що дозволяє їм збільшити довжину за рахунок ширини.
Втрата зовнішніх сегментів в ховрахів
Часткова чи повна втрата зовнішніх сегментів колбочок була виявлена у ховрахів, що впадають в зимову сплячку, чия сітківка містить ~85 % колбочок.
В одних з перших досліджень впливу сплячки на сітківку ховрахів було показано, що після входження в зимову сплячку, зовнішні сегменти колбочок ховраха тринадцятисмугового ставали коротшими чи взагалі зникали, а діаметр дисків зменшувався, однак без якого-небудь збільшення кількості фагосомів пігментного епітелію сітківки. У порівнянні ЗС колбочок, ЗС паличок ховраха не змінювались протягом сплячки.
Разом із змінами ЗС, змінювались також інші складові колбочки ховраха, що перебував у сплячці: зменшення кількості та довжини мітохондрії у внутрішньому сегменті, зниження кількості синаптичних везикул та синаптичних ніжок. Часткове повернення до нормальної довжини ЗС у ховраха відбувалось через один тиждень після пробудження із сплячки, і закінчувалось повністю ще через тиждень. Відновлення синаптичної морфології та мітохондрій відбувалося швидше, приблизно за 3 дні.
Внутрішній сегмент
Внутрішній сегмент (ВС) фоторецептора — це тіло клітини, в якому містяться ядро, мітохондрія та ін. клітинні органели. Його анатомія спеціалізована для забезпечення високого рівня енергії та синтезу білків, необхідних для підтримки функціювання фоторецептора.
У колбочок ВС зазвичай більш об'ємисті із щільно упакованими в еліпсоїдному регіоні округленими мітохондріями, тоді як у паличок ВС містять менше мітохондрій, які є довшими та тоншими від колбочкових. Те, що колбочки мають більший ВС ніж палички пов'язане скоріш за все з їх більшими метаболічними потребами у порівнянні із паличками.
На відміну від ЗС, ВС паличок і колбочок не є шаруватими, але в них щільно упаковані мітохондрії.
ВС прийнято ділити на дві частини: еліпсоїд та міоїд.
Еліпсоїд
Еліпсоїд — це віддалена частина ВС (ближча до ЗС), що містить щільно розміщені видовжені мітохондрії, які вирівняні по колу вздовж осі фоторецептора. Діаметр мітохондріального еліпсоїда колбочок людини становить 2,5 — 5 мкм, тоді як, до прикладу, в черепах — 7 – 12 мкм, а в курей — 2-3 мкм.
В макак колбочки містять в 9-10 разів більше мітохондрій ніж палички. У них мітохондрії складають 74-85 % еліпсоїдів колбочок, та 54-66 % еліпсоїдів паличок. Об'єм їх еліпсоїда з відстанню від центральної ямки збільшується в 2,4 раза для паличок та більше ніж в 6 разів для колбочок на відстані до ~13 мм, в той час як об'єм ЗС є сталим для обох фоторецепторів. Більша кількість мітохондрій в колбочці ніж в паличці є дивним, з огляду на те, що механізм фототрансдукції в них майже однаковий.
Метаболічні функції мітохондрій
Мітохондрії у фоторецепторах виконують подвійну функцію. Як і в інших клітинах, у фоторецепторах вони виконують метаболічні функції, бувши генераторами аденозинтрифосфату (АТФ). Фоторецептори, зокрема їх ВС, характеризуються високим споживанням кисню. ВС колбочок мають інтенсивне гістохімічне фарбування цитохром-с-оксидази та відносно високе споживання кисню. Більшість з енергії, яка генерується у ВС колбочок, підтримує перекачування іонів натрію та обмін цГМФ. В темряві, за відсутності світлового стимулювання, натрій-калієвий насос в плазматичній мембрані ВС характеризується надзвичайно швидкою активністю, потрібною для балансування великого потоку натрію через багато відкритих цГМФ-регульованих каналів в ЗС
Крім того, мітохондрії еліпсоїда забезпечують високу частоту синтезу білків в міоїді ВС для забезпечення високого рівня фототрансдукції білків в ЗС. Так, ЗС палички містить до 5×107 молекул родопсину, із яких 10 % фагоцитуються пігментним епітелієм сітківки з настанням світла кожного дня, тому для постійної підтримки кількості родопсину в ЗС, в еліпсоїді щодня синтезується до 5×106 молекул родопсину і переміщається до основи ЗС.
Оптичні функції мітохондрій
Крім метаболічних функцій, фоторецепторні мітохондрії у ВС мають також і оптичні функції. Показник заломлення ВС та ЗС є вищим від показника заломлення проміжного середовища, завдяки чому у фоторецепторі є можливим повне внутрішнє відбиття, що обмежує світло в границях рецептора і він діє як хвилевід.
Еліпсоїд має вищий показник заломлення у порівнянні з іншими частинами фоторецептора, що обумовлено щільністю мітохондрій, які тому повинні виконувати також оптичні функції. Завдяки вищому показнику заломлення, поперечна площа ВС, а не ЗС, визначає площу схоплення фотонів фоторецептора і дозволяє еліпсоїду спрямовувати світло до ЗС. Вимірювання подвійних колбочок зелених сонячних окунів (Lepomis cyanellus) виявили систематичні градієнти показника заломлення у ВС колбочок, який збільшується від 1,38 до 1,42 уздовж поздовжньої осі ВС.
Місце вздовж ВС, де поєднання конічної форми та збільшеного показника заломлення у порівнянні з позарецепторним простором, ініціює хвилевідність в напрямку ЗС і визначається, як оптична вхідна апертура фоторецептора. В колбочках центральної ямки людини апертура добре корелює з розташуванням мітохондрій, за винятком колбочок в середині центральної ямки, в яких апертура є ближчою до зовнішньої пограничної мембрани.
Оптичні, більш ніж метаболічні, функції фоторецепторних мітохондрій дозволяють пояснити відмінність між кількістю мітохондрій у ВС паличок та колбочок (особливо периферійних) сітківок людей та мавп. Їх широкі та конічні ВС, у порівнянні з вузькими та широко розставленими ЗС, можуть сприяти у схопленні та спрямуванні світла до фотопігменту в ЗС. На відміну від мавп та людини, різниця між діаметрами ЗС та ВС паличок і колбочок сітківок мишей та кішок не така значна, тому між ними і менша різниця в кількості мітохондрій та метаболічній активності, що вказує на меншу важливість еліпсоїдних мітохондрій колбочок для хвилевідних властивостей.
Найбільш очевидними оптичні властивості мітохондрій фоторецепторів є в тупаєподібних та землерийок, чиї колбочки містять поряд з меншими мітохондріями кілька великих мітохондрій («мегамітохондрій»), що мають нерегулярні крісти і діють як мікролінзи, підсилюючи оптичні функції колбочок. Такі великі мітохондрії могли з'явитись як заміщення олійних краплин , які були в пращурів тупаєподібних. Середній показник заломлення ізольованого ВС колбочки малайської тупаї (Tupaia belangeri) вищий (1,405), ніж будь-якого іншого вивченого ссавця.
Вивчення мітохондріальних еліпсоїдів ВС одиничних колбочок курки (Gallus gallus domesticus) показало, що у фоторецепторів птахів еліпсоїди слугують не для покращення схоплення світла, а скоріш для зменшення погіршення оптичних функцій фоторецептора через розсіяння світла по ньому. У колбочок птахів еліпсоїд має ту саму ширину, що й олійна кольорова краплина і змінює апертурний кут фоторецептора, тому незначним чином покращує передачу світла від ВС до ЗС.
В деяких ящірок та міногових найближчі області еліпсоїдів колбочок містять скупчення збільшеного ендоплазматичного ретикулуму, відомі як «заломлюючі тіла», які виконують функцію збирання та спрямування світла.
Міоїд
Частина ВС фоторецептора, ближча до тіла клітини, називається міоїд і містить вільні рибосоми, шорсткий ендоплазматичний ретикулум (ШЕР) та комплекс Ґольджі, які відповідають за синтез білків у фоторецепторі.
Термін «міоїд» був запозичений із схожої області фоторецепторів земноводних, яка містить скорочувальну структуру, що відповідає за рух ЗС колбочок для їх орієнтування. На відміну від земноводних, міоїд ВС людини не може скорочуватись, хоча вісь ВС та ЗС зорієнтована на вихідну зіницю ока, в такий спосіб збільшуючи ймовірність схоплення світла фоторецептором.
Із фоторецепторного ядра в ШЕР транспортуються матричні РНК, де транслюються на рибосомах в білки опсинів, які комплексом Ґольджі пакуються в маленькі везикули. Ці везикули транспортуються до з'єднувального війка і потрапляють до ЗС, де включаються в мішки та плазматичні мембрани.
У деяких видів міногових (геотрія (Geotria australis)), ящірок (Ctenophorus ornatus) та рогозуба міоїд колбочок та колбочкоподібних фоторецепторів цілком містить жовтий/помаранчевий пігмент, який подібно до олійних краплин, діє як спектральний фільтр, поглинаючи довжини хвиль світла нижче ~500 нм. У пращурів геотрії ці жовті міоїдні пігменти скоріш за все виникли як адаптація до харчування на поверхні морських вод, де на їх очі постійно впливають шкідливе (з високою енергією) короткохвильове світло. Крім того, фільтр, який поглинає короткі хвилі може також запобігти фотостимуляції β-діапазону фотопігментів та звузити спектральну чутливість різних типів колбочок, зміщуючи пік їх чутливості і тим самим покращуючи розрізнення кольорів.
З'єднувальна війка
Внутрішній сегмент фоторецептора поєднаний із зовнішнім сегментом через тонкі нерухомі з'єднувальні війки (0,3 мкм в діаметрі), що є єдиним фізичним з'єднанням між ЗС та ВС. На відміну від рухомого війка, аксонема з'єднувального війка не має двох мікротрубочок в центрі і тому, ближче до основи, має структура мікротрубочок 9×2+0. Далі від основи війка і через більшу частину ЗС дублети мікротрубочок переходять в структуру 9×1+0 синглетів-мікротрубочок.
Через з'єднувальні війки відбувається потік величезної кількості ліпідів та білків із ВС, де вони синтезуються, до ЗС, де беруть участь у фототрансдукції чи підтримці функціювання ЗС. Щохвилини до 2 тис. молекул транспортується із ВС до ЗС.
Ядро
Ядра паличок та колбочок формують зовнішній ядерний шар сітківки хребетних. У колбочці ядро міститься у внутрішньому сегменті, тоді як в паличці ядро знаходиться в клітинному тілі, відокремленому від внутрішнього сегмента зовнішнім волокном. Ядро паличок та колбочок характеризується високим рівнем транскрипції, оскільки мембранні диски зовнішніх сегментів неперервно оновлюються, тому фоторецептори функціюють як свого роду Апокринні залози з високою активністю.
Клітинні ядра відмінні в паличок та колбочок. Ядро палички більш округле, відносно мале і характеризується розміщенням гетерохроматину в одне щільне скупчення (хромоцентр), яке виглядає темнішим коли забарвлене нуклеофільним фарбуванням. Ядро колбочки є відносно великим та овальним, часто формуючи єдиний шар, що проникає до зовнішньої пограничної мембрани. Колбочкові ядра характеризуються великою кількістю еухроматину і менше гетерохроматину, який організований в кілька невеликих скупчень і тому ці ядра мають менш інтенсивне контрастне фарбування.
Перевернуте ядро палички
В більшості евкаріотних клітин пакування хроматинових ниток має дві форми: 1) еухроматин (нещільна, відкрита форма з активними генами), що знаходиться ближче до ядра, де проходить більша частина транскрипції; та 2) гетерохроматин (ущільнена форма), що часто скупчений довкола ядерець та на периферії ядра і містить транскрипційно неактивні ділянки геному. На відміну від цієї усталеної архітектури ядра, в паличках мишей була виявлена незвична перевернута архітектура ядра: гетерохроматин тут зосереджений в центрі ядра, тоді як еухроматин і фактори транскрипції знаходяться на периферії, де в інших ядер гени не представлені. Така архітектура ядер паличок має важливі функціональні наслідки для нічного зору ссавців, наділяючи їх оптичними властивостями.

При народженні (післяпологовий день P0) палички миші мають звичну для інших еукаріотних клітин архітектуру ядра, але після закінчення проліферації клітин (P5) та відкриття очей (P13) їх ядра набувають перевернуту архітектуру, яка остаточно оформлюється через місяць опісля народження. Аналіз ядра паличок сітківок інших нічних ссавців також виявив перевернуту ядерну архітектуру та її стійку кореляцію з концентрацією паличок і співвідношенням паличок до колбочок.
У більшості ссавців, що ведуть денний спосіб життя, перевернутої організації ядра палички не було виявлено. Винятком є денні лемури — сіфака (Propithecus) та лемур звичайний (Eulemur fulvus), палички яких мають перевернуту архітектуру ядра. Цей виняток може бути пояснений з урахуванням останніх поведінкових досліджень, які показали, що денні лемури насправді ведуть змішаний спосіб життя, бувши активними вдень і вночі. З іншого боку, ядро палички корови має проміжну архітектуру: гетерохроматин знаходиться в центрі і поширюється на периферію, що може свідчити про перехід від перевернутої ядерної архітектури до традиційної, обумовлений скоріш за все адаптацією корів від нічного до денного способу життя після одомашнення. І навпаки, паличкові ядра нічної мавпи характеризуються переходом від усталеної архітектури хроматину до перевернутої, оскільки мають хроматин як на периферії (усталена архітектура), так і в центрі ядра (перевернута архітектура), де він є хромоцентром. Подібна перехідна форма свідчить про повернення нічних мавп від денної активності до нічної, яку вели пращури приматів. Унікальною є сітківка активних вночі довгоп'ятових, в якій, подібно до інших нічних ссавців, менша загальна щільність колбочок, однак присутня характерна для денних приматів центральна ямка та їх паличкові ядра мають усталену архітектуру, що різнить їх з-поміж всіх інших нічних ссавців. Чому довгоп'ятові зберегли усталену архітектуру ядра, — попри те, що значно давніше адаптувались до нічного життя (~40-45 млн років тому), аніж нічні мавпи (~5-19 млн років тому), — станом на 2018 рік залишається незрозумілим.
Оптичні властивості перевернутого ядра

Перевернуті ядра впливають на оптичні властивості паличок, оскільки ці ядра мають нижчий показник заломлення на периферії і вищий, хоч і однорідний, показник заломлення в центрі, де скупчений гетерохроматин. Подібна різниця показників заломлення значно зменшує розсіяння ядром рідкісного в ночі світла та покращує його фокусування для проходження до зорового пігменту в зовнішньому сегменті фоторецептора, поліпшуючи нічний зір.Формування перевернутого ядра в паличці миші в перший місяць після народження відповідає значному скороченню ефективної фокусної відстані ядра із ~27 мкм новонародженої миші до ~12 мкм в дорослої миші.
Перевернута організація паличкового ядра свідчить про те, що воно, подібно до інших сегментів фоторецептора, еволюціонувало для оптимізації проходження світла через перевернуту сітківку до зорового пігменту фоторецептора. На користь цього свідчать числові моделювання поширення світла через перевернуті ядра паличок з допомогою скінченно-різницевого методу в часовій області (FDTD) в двох та трьох вимірах. FDTD-моделювання вказує на те, що перевернуті ядра функціонують подібно до збиральних лінз для проходячого світла, тоді як ядра з усталеною організацією постають, як дифракційно-подібні перешкоди поширенню світла до зовнішнього сегмента палички.
Завдяки округлій формі та оберненій організації хроматину, перевернуте ядро палички володіє центральною симетрією і оптичні властивості паличкового ядра відокремлені від його просторової орієнтації. Тому перевернуте ядро не тільки більш ефективно фокусує світло у паличці, аніж усталене ядро, але й зберігає свої фокусуючі властивості незалежно від його орієнтації. Ці характеристики перевернутого паличкового ядра мають важливі наслідки для зовнішнього ядерного шару, в якому знаходяться клітинні тіла паличок і який в нічних ссавців значно товстіший ніж в денних. В зовнішньому ядерному шарі паличкові ядра розміщені в 6-8 шарів і згруповані у вертикальні колонки, вирівняні таким чином, що знаходяться приблизно на одній лінії з проходячим світлом. Моделювання з використанням FDTD-методу показало, що організація перевернутих ядер паличок в колонки зменшує розсіяння світла і забезпечує (подібно до центральної ямки) ефективний оптичний шлях через всю сітківку нічної тварини. Крім того, зменшення розсіяння в колонках перевернутих ядер паличок стійке до нерегулярностей колонок..
Відносна товщина зовнішнього ядерного шару може бути причиною перевернутої архітектури паличкового ядра нічних ссавців, яка дозволяє в такому потовщеному шарі зменшити розсіяння фотонів і збільшити ймовірність їх схоплення фотопігментом в зовнішньому сегменті палички. Крім того, округла форма перевернутих паличкових ядер з їх центральною симетрією уможливлює фокусування світла без необхідності їх впорядкованого розміщення в зовнішньому ядерному шарі.
Оберненість сітківки і необхідність проходження світла через її клітинні шари перш ніж воно досягне зорового пігменту, вказує на те, що оптичні властивості фоторецепторів та їх складових не менш важливі, ніж їх фізіологічні функції.
Аксонна терміналь
В результаті поглинання фотону фоторецептором у його зовнішньому сегменті запускається каскад фототрансдукції, що призводить до градуйованих змін трансмембранного потенціалу зовнішнього сегмента, який електротонічно поширюється до аксонного термінала, звідки передається іншим нейронам двома способами. Один спосіб — через електричні синапси: пасивне перенесення електричного потенціалу до прилеглих фоторецепторів через внутрішньоклітинні з'єднання (щілинні контакти) з низьким опором. Другий спосіб — через хімічні синапси: зміни мембранного потенціалу на аксонній терміналі міняють внутрішньоклітинну концентрацію іонів кальцію Са2+ та регулюють частоту злиття синаптичних везикул із плазматичною мембраною і вивільнення нейромедіатора (глутамату) на постсинаптичні нейрони сітківки другого порядку.
Ніжки і сферули
Аксонна терміналь фоторецепторів розгалужується в зовнішньому сітчастому шарі сітківки. Аксонна терміналь паличок називається сферулою (лат. spherule, мала сфера), колбочок — ніжкою (лат. pedicle, мала нога). У сітківці ссавців периферійні колбочки мають значно більші ніжки (можуть мати понад 50 синаптичних щілин), аніж колбочки в центральній ямці й, залежно від розташування в сітківці, можуть мати діаметр від 5 до 8 мкм. У сітківці приматів, поблизу центральної ямки, аксони багатьох колбочок групуються радіально таким чином, що ніжки формують кільцевий масив довкола центру.
Синаптична стрічка
Більшість нейронів ЦНС кодують інформацію через зміну в частоті потенціалу дії. Однак фоторецептор повинен передавати сенсорну інформацію про широкий динамічний діапазон інтенсивностей світла, коли найменші зміни в інтенсивності стимулу повинні призводити до явних змін у вивільненні нейромедіатора. Тому фоторецептори кодують інформацію не через потенціали дії, а шляхом постійного тонічного вивільнення нейромедіатора глутамату. Це дозволяє їм неперервно змінювати синаптичні вихідні сигнали залежно від градуйованих змін в інтенсивності світла, вивільняючи від однієї до сотень везикул за секунду.
Високий рівень вивільнення глутамату фоторецепторами обумовлений присутністю в їх аксонній терміналі спеціалізованої синаптичної структури — «стрічки», що є місцем вивільнення глутамату й складається з білка RIBEYE. Стрічка зв'язує везикули з глутаматом і діє подібно до конвеєрної стрічки, щоб піднести везикули до синаптичної активної зони, де вони зливаються з плазматичною мембраною для вивільнення глутамату в синаптичну щілину. Стрічка не прямо приєднана до плазматичної мембрани, а через «дугоподібну щільність» — електрон-щільну мережу білків, прикріплену до плазматичної мембрани.
В ссавців сферули паличок містять тільки одну стрічку (30-35 нм в товщину), тоді як ніжки колбочок містять декілька стрічок, чия кількість варіює між видами. Так, ніжки колбочок миші містять ~10 стрічок, а ніжки ховрахів можуть містити навіть 15 і більше стрічок. Ніжки колбочок приматів можуть містити 20 стрічок в центральній ямці сітківки, та 42 на периферії. Така множина стрічок в кожній ніжці колбочки дозволяє передавати вихідний колбочковий сигнал багатьом класам колбочкових біполярних нейронів.
Колбочки формують із постсинаптичними нейронами два спеціалізовані контакти — стрічкові (інвагінуючі) та плоскі (базальні). Із деполяризуючими (ON-) біполярними та горизонтальними нейронами колбочки формують стрічкові синапси, коли дендрити заглиблюються у ніжку колбочки. Із гіперполяризуючими ( OFF-) біполярними нейронами колбочки формують пласкі контакти, коли дендрити біполярів торкаються основи ніжки колбочки.
Одна колбочка може формувати контакти із дендритами 10-12 біполярних нейронів та багатьох горизонтальних клітин, тому в заглибленні ніжки колбочки може бути вміщено до 200 відростків постсинаптичних нейронів, що робить ніжку чи не найскладнішою синаптичною структурою ЦНС. Однак є і відхилення від вищеописаного правила синаптичних зв'язків між колбочками та біполярними нейронами. Нещодавно відкритий новий тип колбочкових біполярних нейронів (XBC), які скоріш за все є ON-біполярами, має нечисельні і переважно нетипові, базальні контакти з колбочками. Крім XBC, було виявлено що й інші типи колбочкових біполярних нейронів (5T, 5O та 8), які мають менше контактів із колбочками аніж повинні, виходячи з розміру їх дендритного поля. У середньому, вони мають контакт з менш ніж однією колбочкою, хоч на відміну від XBC і формують типові, інвагінуючі синапси.
Аксони паличок також формують синапси як із одним типом деполяризуючих біполярних нейронів, так і з горизонтальними нейронами. Однак, на відміну від колбочок, сферули, які мають тільки одну стрічку, контактують лише з двома дендритами біполярного та двома дендритами горизонтального нейрона.
Оскільки фоторецептори, за відсутності світлового стимулу, безперервно вивільняють глутамат, то спеціалізовані синаптичні стрічки призначені для підтримки високої частоти надходження Са2+ і відтак високого рівня вивільнення. До прикладу, палички повинні відокремити із фонового теплового шуму (виникає через спонтанний розпад молекул фотопігменту) та стохастичного вивільнення нейромедіатора, коротку і слабку гіперполяризацію мембрани, що сигналізує поглинання одиничного фотона. Для цього потрібно мінімізувати фонові коливання шляхом утримання високої частоти стійкого вивільнення глутамату у темряві. Вважається, що сферула палички, яка має діаметр 2 мкм та містить дуже велику синаптичну стрічку, є спеціалізованою для підтримки такої високої частоти вивільнення нейромедіатора.
Сферула має єдине заглиблення, що вміщує чотири відростки — два від горизонтальних нейронів і два від дендритів паличкових біполярів, завдяки чому постсинаптичні відростки знаходяться близько до місця вивільнення глутамату, унеможливлюючи його переливання на сусідні палички. Ці анатомічні особливості паличкових сферул істотно зменшують коливання сигналів паличок, уможливлюючи надійне виявлення реакцій на одиничні фотони.
Фоторецепторні синапси також мають ряд молекулярних відмінностей від інших синапсів в нервовій системі. Синаптичні стрічки не містять синапсинів, — білків, що регулюють вивільнення нейромедіаторів в синапсах інших нейронів. На відміну від більшості нейронів, екзоцитоз та вивільнення нейромедіатора у паличках та колбочках регулюють потенціалзалежні кальцієві канали L-типу Cav1.4 (складені із α1F та α1D субодиниць, відповідно) та цГМФ-регульовані канали в колбочках. Крім того, замість синтаксину-1, що здійснює злиття везикул із цитоплазматичною мембраною, в синаптичних стрічках присутній синтаксин-3.
Регулювання вивільнення глутамату
Тонічна деполяризація фоторецепторів за відсутності стимулу може призводити до зниження чутливості (десенсибілізації) багатьох типів іонних каналів, викликати в мембранному потенціалі осциляції з частотою 3-4 Гц та переповнити ВС іонами кальцію. Стійке регулювання вивільнення глутамату залежно від змін мембранного потенціалу здійснюється через розміщений близько до активної зони в сферулі та ніжці потенціал-залежний кальцієвий канал L-типу (Cav1.4. Через цей канал відбувається входження Ca2+, а відтак і регулювання нейромедіаторного вивільнення. На ці Ca2+ L-типу канали не діє потенціал- чи С2+-залежна десенсибілізація, тому вони можуть підтримувати неперервне вивільнення глутамату за відсутності стимулу.
В сферулах паличок Cav1.4-канали пов'язані із кальцій-зв'язувальним білком 4 (англ. CAlcium-Binding Protein 4; CABP4), модуляція яким зміщує потенціал-залежну чутливість Cav1.4-каналу до більш гіперполяризованих мембранних потенціалів. Завдяки цьому Cav1.4-канали модулюються по всьому фізіологічному діапазону потенціалу палички.
Класифікація фоторецепторів
Сітківка людини має чотири типи фоторецепторів (1 тип паличок і 3 типи колбочок), кожен з яких є найбільш чутливим до конкретного діапазону електромагнітного випромінювання.
Колбочки найімовірніше були першими фоторецепторами в еволюційній історії, а палички розвинулись пізніше, як результат трансмутації колбочок. В цій самій послідовності (спочатку колбочки потім палички) формуються фоторецептори під час ембріологічного розвитку ока ссавців.
Палички, що відповідають за зір в темряві та при зоряному світлі, складають ~95 % всіх фоторецепторів ссавців, мають тонкі довгі зовнішні сегменти, складені з окремих дисків, відокремлених від плазматичної мембрани і є в 1000 разів більш чутливими до світла, ніж колбочки. Людська сітківка містить близько 100 млн паличок
Три типи колбочок, що відповідають за гострий зір при денному світлі, складають лише ~5 % фоторецепторів, є більшими за розміром, мають коротші конусоподібні зовнішні сегменти, диски яких неперервно з'єднані з мембраною. Сітківка людини містить ~5 млн колбочок. Для порівняння, сітківка миші містить ~190 тис. колбочок, де вони складають 2,8 % від всіх фоторецепторів.
Традиційно три типи колбочок, які відповідають за триколірний зір у людини та деяких мавпових, називались «сині», «зелені» та «червоні», припускаючи, що збудження даного типу колбочки визначало відповідне кольорове сприйняття. Однак така термінологія наразі вважається не коректною, оскільки кольорові назви не відповідають ні довжинам хвиль максимальної чутливості колбочок, ні кольоровим сприйняттям, які постають після збудження одиничних колбочок.
Натомість сьогодні загальноприйнятим є позначення колбочок як S-, M- та L-колбочки, залежно від тієї частини видимого спектра, до якої кожна є найбільш чутливою (від англ. Short-, англ. Middle- та англ. Long-wave sensitive, відповідно: коротко-, середньо- і довгохвильові колбочки). Хоча спектри поглинання фотопігментів S-, M- та L-колбочок значно перекриваються, їх довжини хвиль максимального поглинання (λmax) знаходяться в різних частинах видимого спектра: 420, 530 та 558 нм відповідно. Хоча фоторецептори можуть поглинати світло і на 50 нм більше чи менше від їх максимальних довжин хвиль, вони такі фотони поглинають менш сильно і тому їх реакція на світло спадає чим далі його довжина хвилі від оптимальної для даного фоторецептора довжини хвилі.
З точки зору властивостей зорових пігментів, в людини та ін. триколірних тварин доречно виділяти три, а не два типи фоторецепторів, оскільки колбочковий SMS1 пігмент настільки ж віддалено пов'язаний із колбочковими M/LWS пігментами, як вони із RH1 паличковим пігментом.
Типи паличок
В більшості сітківок тварин наявний лише один тип паличок, і тільки земноводні мають два типи паличок.
«Зелені» та «червоні» палички земноводних
Подібно до інших хребетних, у земноводних наявні палички з родопсином Rh1, що має максимум поглинання з довжиною хвилі 500 нм (т. зв. «червоні палички»), які були описані ще Максом Шульце (1867 р.) в сітківці жаб. Однак 1874 р. німецький анатом Густав Швальбе виявив, що дорослі жаби мають особливий з-поміж інших тип паличок — т. зв. «зелені палички» (або «палички Швальбе»), в яких коротший циліндричний зовнішній сегмент (~5-8 мкм в діаметрі та 60 мкм в довжину) та довший тонкий міоїд внутрішнього сегмента в порівнянні з «червоними» паличками.. Максимум поглинання зорового пігменту зелених паличок — 432 нм
Назви цих паличок не пов'язані з їх спектральною чутливістю, а з притаманним їм кольором у препарованій тканині сітківки, коли їх розглядати під мікроскопом: у більшості земноводних зелені палички мають колір трави, хоча у вогняної саламандри їм притаманний блідий сіро-зелений колір. Адаптовані до темряви червоні палички, подібно до інших хребетних, найбільш чутливі до жовто-зеленого світла, тоді як зелені палички — до фіолетового-синього (подібно до S-колбочок інших хребетних), пропускаючи зелений колір, звідси їх назва.. Хоча колір фотопігменту зелених паличок, виходячи з його спектра поглинання, повинен бути жовтим, під мікроскопом ці фоторецептори виглядають зеленими, можливо через поєднання оптичних властивостей зелених паличок (дуже тонкий міоїд внутрішнього сегмента неефективний для передачі жовтого світла) та людського кольорового зору (через контраст пігменту «зелених» паличок з багрянисто-червоним фоном родопсинових «червоних» паличок).
У жаби леопардової зелені палички складають 8 % всіх фоторецепторів, а червоні палички — 50 %, тоді як у тигрової саламандри червоні палички складають 98,6 % всіх паличок, а зелені — 1,4 %. Подібно до міоїдів колбочок жаб, міоїд зелених та червоних паличок жаб витягується у відповідь на адаптацію до світла, щоб краще схоплювати падаючі фотони.
Колбочковий фотопігмент «зелених паличок»
Зелені палички земноводних мають однаковий з S-колбочками опсин, тому сформований цим опсином пігмент («SWS2,P432», англ. Short-wavelength sensitive opsin of class 2) зелених паличок має ту саму спектральну чутливість, що й SWS1 пігмент S-колбочки. Подібно до колбочкових пігментів, фотопігмент зеленої палички також руйнується (знебарвлюється) за присутності гідроксиламіну.
Хоча зелені палички та S-колбочки містять один і той же зоровий пігмент, у тигрової саламандри була виявлена унікальна з-поміж усіх хребетних особливість: зелені палички та S-колбочки мають відмінні молекули трансдуцину (паличкову a-субодиницю трансдуцину в зеленій паличці та колбочкову а-субодиницю в S-колбочці), які активуються одним і тим же пігментом, однак це не впливає на світлову чутливість чи кінетику реакцій цих двох фоторецепторів Тож, хоча морфологічно зелені палички є паличками, їх опсини є колбочковими, порушуючи усталений поділ фоторецепторів відповідно до їх морфології і прив'язку функції рецептора до його морфології. Оскільки вважається, що палички еволюціонували із колбочко-подібних фоторецепторів і родопсин еволюціонував із колбочкових пігментів SWS2, то характерні риси зелених паличок можуть свідчити про те, що ці фоторецептори є проміжною ланкою в еволюційній трансформації колбочок в палички..
Іншою унікальною рисою зелених паличок земноводних є те, що їх подібний до S-колбочок опсин є надзвичайно стабільним: зелені палички мають дуже малий рівень спонтанної теплової ізомеризації — <10−14 теплових ізомеризацій/с при 23°С. З цього випливає, що SWS2 (колбочковий) пігмент зеленої палички земноводних спонтанно активується в середньому один раз кожні ~1014 с, тобто ~4000 років, що робить його найбільш стабільним із всіх відомих опсинів, включно з родопсинами, які з-поміж всіх інших зорових опсинів мають найменший рівень спонтанної теплової ізомеризації (~0,01 с−1).
Зелені палички наявні тільки в земноводних і хоча мають схожу з паличками морфологію, для них характерна поведінка S-колбочок, тому ці палички розширюють діапазон чутливості S-колбочок і можуть бути залучені в трикольоровий зір, зокрема в розрізнення кольорів на мезопічному рівні освітлення та відповідати за інстинктивну, позитивну фототаксичну реакцію на синє світло, характерну для багатьох безхвостих
Типи колбочок
Серед більшості видів тварин палички мають відносно однакову структуру, відрізняючись лише довжиною та діаметром зовнішніх сегментів. Тоді як колбочки характеризуються більшими відмінностями поміж різних видів.
Подвійні колбочки
Якщо одиничні колбочки є характерними для більшості хребетних, то деякі з них мають окрім одиничних, також подвійні колбочки , як то птахи, плазуни, земноводні, кісткові ганоїди та костисті риби. А в деяких груп костистих риб навіть були виявлені потрійні колбочки.
Подвійні колбочки зазвичай складаються із двох відмінних колбочок, злитих разом в їх міоїдах внутрішніх сегментів та значно різняться розмірами. Більша («основна») колбочка із подвійних колбочок часто має олійні краплини, тоді як менша («додаткова») містить великий параболоїд, хоча в різних видів присутні різні комбінації розмірів та структур подвійних колбочок.
Подвійні колбочки скоріш за все еволюціонували близько 350—400 млн років тому і, хоча вони наявні в сітківках майже більшості наземних хребетних (включаючи однопрохідних та сумчастих), цілком відсутні в сітківках дводишних та плацентарних ссавців, у тім числі в людини.
Квадратна мозаїка подвійних колбочок
В сітківці костистих риб подвійні колбочки організовані у характерну впорядковану мозаїку (у формі квадрату чи в ряд). Як правило, в квадратній мозаїці подвійні колбочки (найчастіше довгохвильові L-колбочки) формують сторони квадрату, а в центрі знаходиться одинична колбочка (короткохвильова S-колбочка), і одиничні колбочки (деякі чутливі до ультрафіолету) по кутах квадрату. Хоча такий порядок колбочок варіюється і в одних костистих риб можуть бути відсутні центральні, а в інших кутові одиничні колбочки.
Для пояснення переваг квадратної мозаїки було запропоновано кілька гіпотез. Одні припускають, що така впорядкованість подвійних колбочок уможливлює краще виявлення руху швидкої жертви, тоді як відповідно до інших квадратна мозаїка також покращує кольоровий зір. Однак наразі відсутні експериментальні дані, котрі б підтверджували переваги впорядкованої мозаїки у порівнянні із невпорядкованою для виявлення жертви костистими рибами.
Інші гіпотези припускають, що квадратна мозаїка може бути залучена для виявлення поляризованого світла шляхом поєднання ортогонально розміщених подвійних та ультрафіолетових одиничних колбочок, зокрема для орієнтації в підводних світлових полях лососевими рибами. Хоча який саме механізм відповідає за чутливість колбочок до поляризованого світла і в яких видів костистих риб, залишається предметом дискусій. Класична модель припускає, що градієнти показників заломлення у внутрішніх сегментах подвійних колбочок можуть функціювати як анізотропні поляризаційні хвилеводи, тому ці колбочки діють як аналізатор поляризації. Однак нещодавні електрофізіологічні дослідження подвійних колбочок зеленого сонцевика не підтвердили подібне припущення для цього виду, а в іншому дослідженні середньохвильової колбочки із подвійних колбочок сітківки золотої рибки було виявлене ізотропне поширення поляризованого світла через внутрішні сегменти (осьовий лінійний дихроїзм) колбочок.
Морфологія та фотопігменти подвійних колбочок
Подвійні колбочки характеризуються різноманіттям морфології та зорових пігментів. Дві половинки подвійних колбочок можуть мати різні розміри та містити однакові чи спектрально відмінні фотопігменти. Найбільше різноманіття подвійних колбочок виявлене в костистих риб, в яких дві половинки можуть бути: морфологічно ідентичними та містити однаковий фотопігмент (ідентичні «колбочки-близнюки»); морфологічно ідентичні, але спектрально відмінними пігментами (неідентичні колбочки-близнюки); морфологічно відмінні з ідентичними пігментами (ідентичні подвійні колбочки); морфологічно відмінні з різними пігментами (не ідентичні подвійні колбочки).
В деяких видів риб між двома половинками подвійних колбочок існують електричні з'єднання через щілинні контакти і вони діють як один фоторецептор. Ідентичні колбочки-близнята, в яких обидві половинки містять однаковий пігмент, через електричне з'єднання просто діятимуть, як відносно великий фоторецептор, що схоплює рідкісні фотони при низькому освітленні і тому зустрічаються у видів риб що живуть в глибоких, каламутних чи забруднених водах.
На відміну від приматів, птахи мають окремі групи фоторецепторів для сприйняття кольору (чотири одиничні колбочки для чотириколірності) та яскравості світла, форми і руху (подвійні колбочки). В птахів подвійні колбочки складаються із однієї великої та однієї малої колбочки, які називаються «головними» та «додатковими», відповідно і використовуються ними для виявлення руху, контурів, текстури та яскравості світла. Дві половинки подвійних колбочок у птахів не є морфологічно ідентичними.
Також, на відміну від приматів, птахи зберегли всі чотири класи колбочкових зорових пігментів: в подвійних та одиничних колбочках вони мають LWS пігмент, а Rh2, SWS1 та SWS2 в інших одиничних колбочках. У птахів, що активні вдень, ~50 % всіх колбочок становлять подвійні колбочки, ~20 % LWS- та ~20 % Rh2-одиничні колбочки, і 10 % — SWS1- та SWS2-колбочки.
Фототрансдукція
Фоторецептори сигналізують нижчестоячим нейронам поглинання світла через перетворення поглиненого фотона в електричний сигнал. Цей процес, відомий як фототрансдукція, реалізується через складний каскад взаємодії молекул, що зрештою призводить до гіперполяризації фоторецептора (у хребетних, тоді як у безхребетних — до деполяризації), тобто до значної зміни його електричного потенціалу.
Темрявний струм
Фоторецептори, як і інші нейрони, сигналізують інформацію шляхом зміни трансмембраного потенціалу. Однак, на відміну як від інших нейронів ЦНС, так і від фоторецепторів безхребетних, фоторецептори хребетних незвичні, оскільки темрява діє на них, як стимул. У темряві, до появи світла і початку фототрансдукції, мембранний потенціал фоторецептора є відносно деполяризованим і тому він неперервно вивільняє нейромедіатори (глутамат), тоді як стимуляція світлом гіперполяризує мембранний потенціал. На користь цього парадоксального феномену свідчать не тільки чисельні дані внутрішньоклітинних реєстрацій, а й виявлена висока частота зміни фоторецепторних синаптичних везикул в темряві.
За відсутності світлового стимулу збалансований постійний потік катіонів із внутрішнього сегмента фоторецептору до зовнішнього сегмента (відомий, як темрявний струм; англ. dark current) підтримує деполяризацію трансмембранного потенціалу на рівні близько -40 мВ (значно більше, аніж інші нейрони, чий мембранний потенціал спокою близько -65 мВ).. Величина темрявного струму в паличках (-34 пікоампер, пА) та колбочках (-30 пА) є майже однаковою в макак.
Подібно до деяких інших сенсорних рецепторів, палички та колбочки не генерують потенціалів дії, але реагують на стимул (світло) через градуйовані зміни мембранного потенціалу.
В темряві палички споживають більше енергії, аніж під час стимуляції світлом, що обчислюється через частоту гідролізу аденозинтрифосфату (АТФ) за секунду. Це пов'язано з тим, що підтримка циркуляційного темрявного струму потребує постійної активності залежних від АТФ Na+-K+-насосів. Оскільки поглинання світла цілком придушує темрявний струм в паличках, то в темряві вони споживають більше енергії, аніж при світлі. Тоді як в колбочках споживання енергії в темряві таке ж, як і в паличок, але залишається високим навіть при світлі, оскільки в колбочках циркуляційний струм ніколи не зменшується, навіть коли світло знебарвлює понад 90 % зорових пігментів.
Таке високе споживання енергії фоторецепторами пояснює високу концентрацію мітохондрій у їх внутрішньому сегменті. Саме тому сітківка є тканиною тіла з одним із найвищих споживань кисню, навіть більше, аніж мозок.
цГМФ-регульовані канали
Фоторецепторний вхідний струм, який переноситься катіонами натрію (Na+), протікає через розміщені в зовнішньому сегменті фоторецептора регульовані циклічним гуанозинмонофосфатом (цГМФ) неселективні катіонні канали. Тоді як вихідний K+ (катіон калію) струм протікає через нерегульовані, селективні до K+ потенціалзалежні канали, які знаходяться у внутрішньому сегменті фоторецептору. В той час, як вихідний струм K+ має тенденцію до гіперполяризації фоторецептора до рівноважного потенціалу для K+ (-70 мВ), то вхідний струм Na+ має тенденцію до деполяризації фоторецептора. Завдяки присутнім у внутрішньому сегменті фоторецептору в значній кількості Na+-K+-насосів, які викачують Na+ і вкачують K+, фоторецептор здатен утримувати сталу внутрішньоклітинну концентрацію катіонів, підтримуючи постійний темрявний струм.
Колбочки і палички мають молекулярно відмінні цГМФ-регульовані канали, хоча в цілому їм притаманні схожі функціональні властивості. Ці канали належать до родини так званих «циклічним нуклеотидом регульованих каналів» , (ЦНР-каналів), куди також належатьцАМФ-активовані канали, що відповідальні за нюхову трансдукцію рецепторів нюху в носі. Родина ЦНР-каналів складається із А (А1 — А4) та В (В1 і В2)-субодиниць, з яких А-субидиниці є основними, а В — доповнювальними і модулювальними. цГМФ-регульований канал палички складається із трьох субодиниць CNGA1 та однієї CNGB1, а колбочковий цГМФ-регульований канал складається з двох молекул CNGA3 та двох CNGB3. Функціональний комплекс ЦНР-каналу зв'язує чотири молекули циклічного нуклеотиду, тому цей канал має дуже низьку ймовірність відкриття за низької концентрації циклічного нуклеотиду, проте ця ймовірність істотно зростає, коли всі чотири місця зв'язування для ліганду (розміщені в цитоплазматичному C-кінці білка) заповнені.
У темряві концентрація цГМФ у цитоплазмі є високою, завдяки чому цГМФ-регульовані канали в зовнішньому сегменті утримуються постійно відчиненими й уможливлюють сталий темрявний струм. Коли фоторецептор поглинає фотон, концентрація цГМФ зменшується, призводячи до закриття цГМФ-регульованих каналів і, як наслідок, до зменшення темрявного струму та гіперполяризації мембранного потенціалу, в такий спосіб ініціюючи процес зору.
Імовірність відкриття цГМФ-регульованого каналу, що в свою чергу визначає розмір циркулючого струму, залежить від концентрації цГМФ. Така залежність відкриття каналу від концентрації зв'язувальних молекул є кооперативною, із коефіцієнтом Гілла nканал ≈ 2-3 та константою дисоціації Kканал ≈ 20 мкмоль/л цГМФ. В цілому, відсоток відкритих каналів в адаптованих до темряви фоторецепторах є досить малим: для концентрації цГМФ в ~4 мкмоль/л, Kканал мкмоль/л і nканал ≈ 3, в темряві відкритими є лише ~1 % ЦНР-каналів, як в паличках, так і колбочках. Такий невеликий відсоток пояснюється тим, що якби в зовнішньому сегменті було лише стільки цГМФ-регульованих каналів, скільки потрібно для підтримки даного темрявного струму, то для того, щоб всі ці канали були відкритими, необхідна велика концентрація вільних цГМФ і, відповідно, швидке та істотне зменшення такої концентрації у відповідь на стимул.
цГМФ-регульований канал є неселективним катіонним каналом, оскільки пропускає не тільки Na+ і K+, але також Ca2+ і очевидно Mg2+. Для паличкового цГМФ-регульованого каналу, 75-80 % вхідного темрявного струму в ЗС переноситься Na+ і ~15 % Ca2+. Для колбочкового цГМФ-регульованого каналу понад 30 % темрявного струму переноситься Ca2+.
Характерною рисою паличкових і колбочкових цГМФ-регульованих каналів є те, що окрім пропускання дивалентних катіонів (Ca2+ та Mg2+), вони також ними частково блокуються. Одним із наслідків такої блокади є те, що ЦНР-канали фоторецепторів мають дуже малий ефективний (середньоквадратичний) струм одиничного каналу — в діапазоні фемтоампер (10−15А). Такий малий ефективний одноканаловий струм означає, що для даного темрявного струму (~20 — 40 пА) залучається значно більше відкритих каналів — 104 каналів із загальної популяції каналів (106) в зовнішньому сегменті. Залучення великої кількості відкритих малих каналів замість малої кількості великих каналів істотно зменшує дискретний шум, пов'язаний із випадковим відкриттям/закриттям каналів в темряві, тим самим збільшуючи співвідношення сигнал/шум (S/N) світлового сигналу в ~100 разів.
На відміну від інших ліганд-регульованих каналів, для цГМФ-регульованого каналу фоторецепторів не характерна десенсибілізація (падіння чутливості) до його ліганду — цГМФ. Ця унікальна властивість дозволяє цГМФ-регульованим каналам паличок і колбочок а) залишатись відкритими та підтримувати постійний темрявний струм, коли в зовнішньому сегменті наявна стала концентрація вільного цГМФ та б) закриватись тільки у відповідь на зменшення концентрації вільних цГМФ внаслідок появи світлового стимулу.
Перетворення світла в нейронний сигнал
Поглинання зоровим пігментом фотону збуджує π-електрон системи кон'югованого подвійного зв'язку 11-цис-ретиналю до його стану Франка-Кондона. З переходом пі-електрону від збудженого стану до основного стану, відбувається цис-до-транс ізомеризація довкола подвійного зв'язку між атомами вуглецю С11=С12 ретиналю.
Фотоізомеризація ретиналю є однією з найшвидших хімічних реакцій — транс-ретиналь формується протягом 200 фемтосекунд і з квантовим виходом 0,65 Однак нещодавні дослідження з використанням надшвидкої «гетеродинної спектроскопії нестаціонарних ґраток» (англ. heterodyne-detected transient grating spectroscopy) виявили, що перший крок в процесі зору є ще більш швидким. А саме, фотоізомеризація 11-цис-ретиналю бичачого родопсину відбувається у коливально когерентний спосіб протягом ~30 фемтосекунд, що збігається з півперіодом торсійного (діедрального) руху C11=C12 зв'язку і свідчить про те, що фотоізомеризація відбувається в межах одного періоду торсійного коливального руху молекули ретиналю. Така надшвидка і надзвичайно ефективна фотоізомеризація, обумовлена квантово-хімічними явищами при переході із основного до збудженого стану, є однією з молекулярних основ високої чутливості зору до світла.
Оскільки енергія фотону спричиняє зміну конформаційного стану хромофору із вигнутого в прямий, із 11-цис-ретиналь у все-транс-ретиналь, то хромофор віддає свою потенційну енергію опсину, що призводить до зміни його конформації до напівстабільної — метародпосину ІІ (МетаІІ). Новий конформаційний стан опсину, МетаІІ, активує трансдуцин (Gt) (гетеротримерний G-білок фоторецептора), який в свою чергу активує фермент фосфодіестерази (ФДЕ) — один із найшвидших серед ферментів. Активована ФДЕ гідролізує циклічний гуанозинмонофосфат цГМФ до ГМФ, який, на відміну від цГМФ, не є сигнальною молекулою.

В темрявному стані (до ізомеризації ретиналю) цГМФ регулює відкриття іонних каналів, через які проходять іони натрію (Na+). Після гідролізу цГМФ фосфодіестаразою, концентрація цГМФ в зовнішньому сегменті зменшується, одночасно зменшуючи кількість відкритих ЦНР-каналів, через які проходить вхідний Na+-струм. Внаслідок закриття ЦНР-каналів, К+ катіони, які виходять із внутрішнього сегмента більше не збалансовуються Na+, що входить у зовнішній сегмент. Порушений баланс катіонних струмів спричиняє повний вихідний електричний струм, відомий як фотострум, який збільшує трасмембранну різницю потенціалів, що гіперполяризує фоторецептор. Гіперполяризація зменшує вивільнення його синапсом нейромедіатора глутамату, таким чином сигналізуючи нижчестоячим нейронам про схоплення фотону. Тож, на відміну від інших нейронів, реакція на світло постсинаптичних до фоторецептора нейронів сітківки пов'язана не зі збільшенням вивільнення рецептором нейромедіатора, а зі зменшенням.
Каскад фототрансдукції істотно підсилює сигнал, оскільки один фотон (і, відповідно, єдина ізомеризація) призводить до гідролізу ~105 молекул цГМФ. Однак фототрансдукція так само ефективно зупиняє передачу сигналу, задля швидкої реакції фоторецептора на новий стимул, що потребує інактивації всіх активних складових залучених у процес сигналізування. У паличках і колбочках ссавців деактивація каскаду фототрансдукції починаються надзвичайно швидко після активації, менш ніж через 40 мс, і тому деактивація майже конкурує з активацією.
Припинення сигналізування розпочинається із фосфорилювання активованого родопсину ферментом родпсинкінази, що призводить до зв'язування фосфорильованого родопсину з білком арестином. Врешті, інактивований метародопсин ІІ (ІІІ) розпадається до внутрішньо інактивної форми метародопсину ІІІ (Мета ІІІ), який розділяється на опсин та вільний все-транс-ретиналь — процес, відомий як знебарвлення, оскільки жоден з цих компонентів не поглинає у видимому спектрі світла. Потім опсинний комплекс втрачає все-транс-ретиналь з арестином та фосфорилюється ферментом фосфатазою (PP2А). Як наслідок, іонні канали в зовнішніх сегментах відчиняються і фоторецепторний мембранний потенціал повертається до темрявного, деполяризаційного рівня. А все-транс-ретиналь перетворюється з альдегідної в спиртову форму — все-транс-ретинол. Далі відбувається дифузія транс-ретинолу із фоторецептора до клітин пігментного епітелію, де він перетворюється у все-транс-ретинілестер (англ. all-trans-retinylester), що реізомеризується до 11-цис-ретинолу та дегідрогенізується до 11-цис-ретиналю, який повертається до фоторецептора і знову зв'язується з опсином, бувши готовим до нового циклу фототрансдукції.
Регулювання фототрансдукції Cа2+
В темрявному стані втікання вхідного струму до зовнішнього сегмента через цГМФ-регульовані канали переноситься головним чином іонами Na+, однак значна частка цього струму (~15 % в паличках і понад 30 % в колбочках) також переноситься іонами кальцію (Ca2+). Ca2+ модулює функцію кількох білків, залучених в процес фототрансдукції. Так, відновлення мембранного потенціалу колбочки та зменшення колбочкової чутливості внаслідок адаптації до світла обумовлені повільним зменшенням концентрації Ca2+ в зовнішньому сегменті протягом тривалого освітлення (протилежні зміни відбуваються під час адаптації до темряви).
В темряві стале втікання Ca2+ балансується рівним та протилежним витіканням Ca2+, керованим Na+/ Ca2+,K+ насосами в плазматичній мембрані ЗС. В адаптованих до темряви фоторецепторах цитоплазматична концентрація вільних Ca2+ коливається в діапазоні 250—700 наномоль (нмоль).
Під впливом освітлення, що призводить до насичення фоторецептора, закриваються всі цГМФ-реульовані канали в ЗС. Це призводить до блокування втікання іонів Ca2+, внаслідок чого цитоплазматична концентрація Ca2+ зменшується до мінімального значення 10-50 нмоль. Повільне зменшення концентрації Ca2+ уможливлює відновлення мембранного потенціалу колбочок від їх гіперполяризаційного відгуку на яскраве освітлення, оскільки Ca2+ гальмує активність гуанілатциклази (ГЦ) — ферменту, що синтезує цГМФ із гуанозинтрифосфату (ГТФ). Тож в темряві, коли рівень Ca2+ є відносно високим, ГЦ знаходиться в частково інгібованому стані, а з повільним зменшенням концентрації Ca2+ під час освітлення відбувається послаблення гальмівного впливу Ca2+ на ГЦ. Внаслідок цього із ГТФ синтезується більше цГМФ, що призводить до повільного збільшення концентрації цГМФ в зовнішньому сегменті. Врешті цГМФ-регульовані канали знов відкриваються і колбочка повільно деполяризується.
Зменшення концентрації Ca2+ запускає механізм негативного зворотного зв'язку, що регулює фототрансдукцію і, як наслідок, активну адаптацію фоторецептора до світла. Так, із повільним зменшенням рівня Ca2+ пов'язане зменшення чутливості (десенсибілізація) колбочки протягом адаптування до світла. Оскільки зниження концентрації Ca2+ призводить до інактивації фотопігментів, то ефективність даного спалаху світла в активації ФДЕ зменшується.
Низький рівень Ca2+ також зменшує чутливість цГМФ-регульованих каналів до змін в цГМФ. Внаслідок такого зворотного впливу Ca2+ потрібен більш інтенсивний світловий стимул для закриття такої ж самої кількості ЦНР каналів. Крім того, дія Ca2+-зв'язувального білка рековерину на родопсинкіназу прискорює фосфориляцію родопсину, тим самим зменшуючи активацію трансдуцину.

Фоторецепторний відгук на світло
Гіперполяризаційний відгук
В темряві мембранний потенціал колбочок на рівні -35 мВ, а паличок -30 мВ, що є достатньо деполяризованим, щоб активувати Ca2+-канали L-типу і запустити синаптичне вивільнення нейромедіатору глутамату. Поява світлового стимулу призводить до гіперполяризації мембрани в зовнішньому сегменті фоторецептора, що електротонічно поширюється до синаптичної терміналі та зменшує вивільнення глутамату. Цей відгук залежить від кількості світла: чим яскравіше воно, тим більшою є мембранна гіперполяризація і тим менше вивільнення глутамату. Відтак, на відміну від інших нейронів, відгук фоторецептора на стимул (світло) проявляється у гіперполяризації, а не деполяризації мембранного потенціалу. Але, подібно до інших сенсорних нейронів, фоторецепторний сигнал переноситься не потенціалами дії, а через тонічну градуойовану зміну потенціалу.
Оскільки фототрансдукція здійснюється системою вторинних посередників, то відгуки паличок і колбочок на світло є відносно повільними. До прикладу, при кімнатній температурі гіперполяризація паличок земноводних у відповідь на тьмяне світло досягає пікової амплітуди за ~1 с, і потім ще 1-3 с спадає. З іншого боку, відгук паличок ссавців (при 37°С) в середньому у 5 разів швидший. Так, в макак відгук на тьмяний спалах світла досягає піку через ~200 мс і в середньому триває 300 мс.
На відміну від паличок, відгук колбочок на світло характеризується значно швидшою кінетикою. У приматів відгук колбочки на тьмяне світло досягає пікової амплітуди через ~50 мс. Швидкість відгуку на світло обумовлює те, як швидко фоторецептор здатен виявити зміни зображення на сітківці (часова роздільна здатність) а, відтак, виявити рух стимулу[уточнити]. Позаяк колбочки мають швидшу кінетику відгуку на світло, вони є краще виявляють та сигналізують рух. Тоді як більш повільна кінетика відгуку паличок дозволяє їм об'єднати розсіяні в часі сигнали (часова інтеграція), тим самим значно підсилюючи чутливість зору при тьмяному освітленні, особливо для статичних зображень на сітківці.
Відгук на поглинання одиничного фотона
Психофізичні дослідження встановили, що палички є найбільш чутливими до світла фоторецепторами, бувши в змозі сигналізувати поглинання одиничного фотона. Вимірювання з допомогою внутрішньоклітинних мікроелектродів виявили, що однофотонний відгук паличок є досить великим, призводячи до тимчасового зменшення темрявного струму на ~0,5 — 1 пА як у ссавців, так і земноводних.
В ізольованій паличці амплітуда струму у відповідь на поглинання одиничного фотона призводить до гіперполяризації мембрани в діапазоні -0,64 — 1 мВ. Коли викликана одиничним фотоном тимчасова зміна в струмі становить 1 пА або вище, то вона може бути виявлена за допомогою всмоктувальної піпетки. Враховуючи що темрявний струм в паличках земноводних коливається в діапазоні ~20-40 пА, то відгук на одиничний фотон складає 3 % від амплітуди максимального відгуку на світло. Тобто, лише ~30 поглинених фотонів можуть викликати відгук палички, рівний половині амплітуди максимального відгуку. Такий великий сигнал відображає притаманне лише паличкам підсилення каскаду фототрансдукції.
Вивчаючи відгук паличок жаб, було виявлено, що вплив поглиненого фотона не поширюється досить далеко у зовнішньому сегменті палички — всього лише ~2 мкм вздовж ЗС (який у жаб ~60 мкм). Таке обмежене поширення відгуку на одиничний фотон пов'язане із щільно упакованими мембранним дисками, що створюють бар'єр для поздовжнього поширення молекулярного відгуку в ЗС, тим самим обмежуючи фототрансдукцію до невеликої ділянки ЗС. З іншого боку, радіальне поширення фототрансдукції в ЗС у відповідь на поглинання фотону є відносно швидким.
Характерною рисою відгуку паличок на одиничний фотон є унікальна постійність в його амплітуді та кінетиці від спалаху до спалаху, завдяки чому саме палички надійно виявляють рідкісні фотони при низьких інтенсивностях світла. Однак така стабільність відгуку палички розходиться з нестабільністю каскаду фототрансдукції. Довгий час вважалось, що якщо активована поглинанням фотону молекула родопсину повністю інактивується в один молекулярний крок, то час існування активної форми повинен бути стохастичним, а, відтак, амплітуда та час однофотонного відгуку повинні істотно коливатись.
Тільки нещодавно було переконливо показано, що відсутність коливання у відгуку палички на одиничні фотони пов'язана з тим, що а) родопсин не інеактивується одним молекулярним кроком та б) інактивація родопсину не є панівною в тривалості цього відгуку. Дослідження паличок миші показали, що саме деактивація молекули трансдуцину є панівною постійної часу однофотонного відгуку. Оскільки кожна молекула родопсину активує ~20 молекул трансдуцину, то усереднення по розпадах багатьох молекул трансдуцину може пояснити сталість розпаду однофотонного відгуку палички. З іншого боку, амплітуда сталого відгуку палички на одиничний фотон пов'язана з розпадом родопсину. Усереднення множинного фосфорилювання активної молекули родопсину є достатнім для пояснення сталої амплітуди однофотонного відгуку.
Разом з тим, на прикладі паличок земноводних, у 1990-ті роки було показано, що однофотонний відгук паличок все ж є досить мінливим, з високим коефіцієнтом варіації (середнє квадратичне відхилення поділене на середнє арифметичне) ~0,4. Крім того, нещодавно було показано на прикладі препарованих паличок миші, що вони проявляють значно більший однофотонний відгук, аніж було виявлено попередніми дослідженнями (~1 мВ) — з середньою амплітудою 2-3 мВ в паличках з максимальним відгуком ~20 мВ. Такий відносно великий однофотонний відгук робить менш проблематичним синаптичну передачу цього відгуку до нижчестоячих паличкових біполярних нейронів, аніж вважалось раніше.
На відміну від паличок, відгук колбочок на одиничні фотони є для різних видів тварин і типів колбочок в 10-100 разів меншим і коротшим. Подібна відмінність однофотонного відгуку паличок і колбочок пов'язана головним чином з їх різницею в підсиленні каскаду фототрансдукції. у порівнянні з паличками, в колбочках підсилення молекулярних реакцій в процесі фототрансдукції є значно меншим, при тому, що обидва типи фоторецепторів майже в однаковій мірі здатні до поглинання одиничних фотонів.
Електроретинограма фоторецепторного відгуку
Відгук фоторецепторів на світло може бути виявлений як з допомогою внутрішньоклітинних мікроелектродів, так і з використанням електроретинограми (ЕРГ) — реєстрація електричної активності всієї сітківки у відповідь на світловий стимул з допомогою зовнішніх електродів, один з яких ставиться на рогівку цілісного ока, а інший на яку-небудь довільну точку на тілі. ЕРГ має кілька компонент, серед яких найбільш ранній компонент (негативна а-хвиля) виражає активність колбочок і паличок.
Використовуючи короткі яскраві спалахи світла, було визначено, що ранні стадії електроретинограм складаються із двох частин — первинний «ранній рецепторний потенціал» із дуже короткою затримкою, після якого слідує більший «пізній рецепторний потенціал». Висхідна фаза пізнього рецепторного потенціалу відповідає а-хвилі електроретинограми. Згодом було показано, що ранній рецепторний потенціал пов'язаний не із змінами в мембранній провідності, а з переміщенням зарядів в молекулах фотопігменту протягом процесу ізомеризації після поглинання фотонів. Тобто, ранній рецепторний потенціал відображає результат поглинання світла, а не сам процес відгуку фоторецептора на нього, що призводить до сприйняття світла. Тільки пізній рецепторний потенціал а-хвилі відображає протікання струмів через клітинну мембрану фоторецепторів і тому є ключовим компонентом сигнальних процесів сітківки.
Однак α-хвиля не повністю виражає весь час відгуку фоторецептора на світловий стимул, оскільки b-хвиля ЕРГ, яка відображає активність ON-біполярних нейронів, досить швидко слідує після a-хвилі і тому врізається в неї та спотворює фоторецепторний сигнал. Попри це, ЕРГ є корисним в офтальмологічній практиці для виявлення порушень у функціюванні паличок і колбочок.
Фоторецепторний шум
Здатність фоторецепторів виявляти найменші світлові стимули (абсолютний поріг зору) та адекватно кодувати зміни вищих інтенсивностей світла обмежується різного роду шумами — як внутрішніми для фоторецептора, так і зовнішніми, пов'язаними з фізичною природою світла.
Відкриття здатності адаптованого до темряви людського зору виявити одиничні фотони вперше продемонструвало залежність зорового сприйняття від фундаментальних фізичних обмежень, покладаючи поріг відчуття чутливості зору до найменших стимулів. Цей фіксований абсолютний поріг задається незалежним від світлового стимулу темрявним шумом, який накладає нездоланні фізичні обмеження на ефективність фоторецепторів, а відтак обмежує як здатність зору до розрізнення контрастності, так і їх чутливість до тьмяного світла.
Щоб фоторецепторний сигнал можна було виявити, амплітуда мембранного струму фоторецепторів, спричиненого поглинанням фотонів, має перевершувати внутрішні коливання темрявного струму («темрявний шум»). До прикладу, в колбочках макаки пікове значення амплітуди фотоструму одиничного фотона становить ~0,03 пА, а в одиничних колбочках окуня смугастого ~0,14 пА. Однак ці сигнали «невидимі» для фоторецептора, оскільки вони не перевершують коливання шуму темрявного струму, ~0,12 пА2 в макаки і ~0,28 пА2 в окуня. З іншого боку, в паличках пікова амплітуда струму одиничного фотона становить ~1 пА в жаби та 0,7 пА в макаки, що перевершує паличкові коливання шуму темрявного струму (~0,035 пА2 в жаби і 0,030 пА2 в макаки) і дозволяє надійно виявити сигнали, викликані поглинанням одиничних фотонів. Для різних рівнів світла характерні різні типи шумів мембранного струму, що обмежують фоторецепторну ефективність:
- при проміжних інтенсивностях світла поріг покладається статистичними коливаннями у схопленні фоторецептором фотону;
- при найвищих інтенсивностях світла головним джерелом шуму є спонтанна ізомеризація хромофору фотопігменту, що генерує дискретні фоторецепторні відгуки, подібні до тих, які виникають внаслідок поглинання фотонів і тому можуть генерувати хибне «сприйняття» світла (звідси й назва цього шуму — «темрявне світло»). Опсини паличок й S-колбочок є стабільними та характеризуються значно меншою частотою темрявного світла, аніж опсини L- і M-колбочок;
- «безперервний» шум постає в процесі фототрансдукції внаслідок спонтанної активації фосфодіестарази;
- інші джерела фоторецепторного шуму пов'язані із спонтанним вивільнення нейромедіатору і спонтанним відкриттям-закриттям мембранних каналів, що додає незначні коливання фотоструму. Для паличок характерний менший шум каналів, аніж для колбочок, тому лише палички генерують фотострум у відповідь на поглинання одиничного фотона, що є відносно безшумним і надійно передає сигнал про одиничні поглинання.
Шум «темрявного світла»
Зорова система багатьох хребетних є надзвичайно чутливою до світла в умовах адаптації до темряви. Окрім механізму фототрансдукції здатного до значного підсилення сигналу, подібна висока чутливість також потребує теплової стабільності зорового пігменту для зменшення шуму.
Неодмінною властивістю зорової системи хребетних є наявність т. зв. «темрявного світла» (англ. dark light), що виникає внаслідок спонтанної ізомеризації хромофору (ретиналь) фотопігменту в повній темряві, за відсутності світлового стимулу, і може генерувати електричний сигнал, нерозрізнюваний від такого ж сигналу, викликаного поглинанням справжнього світла.
Теплова активація фотопігменту
Причиною спонтанної активації молекули фотопігменту є її внутрішня теплова енергія. Ця теплова енергія фотопігменту виконує дві протилежні функції в процесі зору. З одного боку, теплова енергія розширює спектральну чутливість зорового пігменту до хвиль із великою довжиною (червоного та інфрачервоного спектра), долаючи нестачу енергії довгохвильових фотонів, щоб спричинити активацію пігменту. З іншого боку, теплова енергія може в темряві спонтанно призводити до активації фотопігменту, генеруючи шум і тому накладати обмеження на ефективність фоторецепторів, а відтак і на чутливість зору. Тому для зору при дуже низькому освітленні теплова стабільність зорового пігменту є такою ж важливою, як і здатність схоплювати та сигналізувати одиничні фотони.
Вперше ідею, що зорове сприйняття обмежене шумом в нейронній системі висловив ще Густав Фехнер (1860 р.), який вважав, що абсолютний поріг для виявлення тьмяного світла встановлюється «темрявним світлом» (нім. Augenschwarz) ока. На думку Фехнера, абсолютний поріг є граничним випадком порогу розрізнення (англ. difference threshold) і в режимі тьмяного фону «темрявне світло» постає замість справжнього фонового світла.
В 1943 р. німецький зоолог Хансйохем Оутрум висунув припущення, що причиною «темрявного світла» є спонтанний розпад зорового пігменту родопсину: «Із теплового розпаду родопсину постають ендогенні збурення, які накладають обмеження на ефективність ока». Оутрум вважав, що зорова система зберігає чутливість попри внутрішній тепловий шум фотопігменту завдяки сумації паличкових сигналів нижчестоячими нейронами сітківки.
Американський хімік та біолог Роберт Джордж (англ. Robert C.C. St. George) вивчаючи знебарвлення родопсину in vitro, виявив (1952 р.), що для його знебарвлення потрібна енергія активації від 44 до 48,5 ккал/моль, яка може надійти або як поглинений фотон, або як внутрішнє тепло і їх взаємодія призведе до активації молекули зорового пігменту. Коли, до прикладу, родопсин знебарвлювався білим світлом (фотони з енергією більше 48,5 ккал/моль), то його частота знебарвлення не залежала від температури (має температурний коефіцієнт 1). Тоді як частота теплового знебарвлення в темряві характеризувалась високою залежністю від температури, що відповідає енергії активації 44 ккал/моль.
Джордж також виявив, що при знебарвленні родопсину червоним світлом (фотони з енергією менше ніж 48,5 ккал/моль), частота знебарвлення залежала від температури. Однак сума енергії знебарвного світла і теплової енергії залишалась в діапазоні між 44 і 48,5 ккал/моль, що вказувало на компенсацію енергії фотонів червоного світла тепловою енергією активації, яка надходить із внутрішніх ступенів свободи білкової частини родопсину. Таким чином, активація внаслідок поглинання світла хрофомором може бути об'єднана з енергією активації що походить із внутрішніх ступенів свободи білка.
Найбільш важливим відкриттям експериментів Джорджа було те, що в червоному діапазоні спектру з'являється розбіжність між коефіцієнтами температури поглинання світла та коефіцієнтами температури знебарвлення і квантова ефективність знебарвлення спадає з довжинами хвиль понад 600 нм.
Модель Стайлса-Льюїса
1948 р. англійський фізик та фізіолог Волтер Стайлс запропонував просту квантово-механічну модель для пояснення впливу теплових ефектів на спектральну чутливість (Стаття Стайлса була опублікована у збірнику з невеликим тиражем, який став рідкісним, однак детальний переказ його теорії можна знайти в кінці цієї статті).
Стайлс намагався пояснити психофізичне відкриття майже лінійного відношення між логарифмом спектральної чутливості та частотою світла (1/λ) для довгих довжин хвиль (далеке червоне та інфрачервоне світло). Зокрема, при нанесенні на графік залежності логарифма спектральної чутливості від хвильового числа (1/λ — величина, обернена довжині хвилі, λ), для довгих довжин хвиль криві спектрального поглинання зорових пігментів (фототопічні та скотопічні криві) постають як прямі лінії, паралельні одна одній і спектральна чутливість зорових пігментів спадає поза довгохвильовим світлом.
Теорія Стайлса полягала в наступному. Для активації молекули фотопігменту (ізомеризація хромофору 11-цис-ретиналю до все-транс-ретиналю) потрібна мінімальна енергія активації 





Стайлс припустив, що рівні теплової енергії є чисельними, рівновіддаленими і найкраще описуються розподілом Больцмана, що характеризує ймовірність зустрічі молекул фотопігменту на даних рівнях теплової енергії. Тоді частка молекул з тепловою енергією, більшою ніж Е (


Теорія Стайлса не тільки пояснювала, в загальних рисах, схожість кривих поглинання фотопігментів в червоному кінці спектру, але й передбачала збільшення ефективності (чутливості) зору із збільшенням температури організму. Однак запропонована Стайлсом модель була надто загальною і не враховувала ряд істотних властивостей молекул фотопігменту.
1955 р. англійський фізіолог Пітер Льюїс (англ. Peter R. Lewis) розширив модель Стайлса, включивши внесок множинних мод ( молекулярних коливань) до молекулярної енергії, потрібної для поглинання фотону. Льюїс вважав, що енергія фотону, достатня для переносу молекули фотопігменту від неактивного до активного стану через енергетичний бар'єр повинна бути представлена довшою довжиною хвилі, аніж довжина хвилі максимального поглинання: λ0 > λmax.
Модель Льюїса передбачала, що для складних молекул з множинними модами коливань, частка молекул з тепловою енергією >E є значно більшою і краще описується розподілом Гіншелвуда для множинних мод коливання :
де m+1 — кількість молекулярних мод коливання. Відповідно до теорії Гіншелвуда, енергія активації мономолекулярних реакцій може бути значно більшою, аніж передбачає рівняння Арреніуса, оскільки додаткова енергія також зберігається у внутрішніх ступенях свободи молекул, що включають моди коливання. Використовуючи розподіл Гіншелвуда, Льюїс показав, що криві поглинання фотопігментів описуються 8 — 14 модами коливань. Чим меншою є теплова енергія, потрібна для доповнення енергії фотону, тим менше мод буде залучено.
На основі побудованої моделі Льюїс прийшов до висновку, що для довгих довжин хвиль, спектр поглинання фотопігменту залежить від температури. Крім того, ця модель передбачала, що крива поглинання фотопігменту в червоному кінці спектру не є повністю прямолінійною і пояснювала психофізичне відкриття зміни кольору (в бік помаранчевого) для колбочкового зору в інфрачервоному діапазоні між 900 та 1100 нм.
Кореляція Барлоу
Ідея, що сама лише теплова енергія здатна, подібно до енергії фотонів, ізомеризувати хромофор та активувати фотопігмент, була висунута, логічно розвинута та психофізично підтверджена в 1950-60-х рр. видатним англійським нейрофізіологом Горацієм Барлоу, який припустив, що спонтанна ізомеризація хромофору є джерелом внутрішнього шуму, який накладає нездоланні фізичні обмеження на зорову систему<.
Барлоу висунув оригінальну гіпотезу (1957 р.), що фотопігменти, які поглинають довгохвильове світло (відповідно, фотони з низькою енергією), повинні мати низький енергетичний бар'єр для активації, а відтак високу ймовірність ізомеризації самою лише тепловою енергією, навіть за відсутності світла.
Зокрема, гіпотеза Барлоу припускала, що в основі як спектральних, так і теплових властивостей фотопігменту є спільна енергія активації (Ea) — найменша енергія, потрібна для перенесення молекули фотопігменту через енергетичний бар'єр від неактивного (E0) до першого активного (E1) стану. Тож, теплова активація і обумовлена фотоном активація фотопігменту долають один і той же енергетичний бар'єр. Тому фотон, чия довжина хвилі відповідає максимальній чутливості спектру поглинання (λmax), надає саме цю мінімальну енергію потрібну для активації фотопігменту — 
На основі цих припущень, для передбачення частоти теплової ізомеризації (k) зорового пігменту Барлоу використав розподіл Больцмана: 
В цілому, гіпотези Барлоу, Стайлса і Льюїса можуть бути об'єднані в одну «гіпотезу Стайлса-Льюїса-Барлоу», яка припускає взаємозалежність енергії активації (Ea) та максимального поглинання для різних фотопігментів. Ця гіпотеза включає Ea як константу, залежність якої від енергії фотону, а, відтак, від максимального поглинання, виражається як 
Психофізчние відкриття темрявного світла
1948 року, коли Стайлс запропонував модель впливу теплової енергії на активацію фотопігменту, голландський фізик та фізіолог Гессель де Фріз провів експеримент, який узгоджувався з моделлю Стайлса-Льюїса. Де Фріз підвищив температуру свого тіла в гарячій ванні з 37°С до 39°С. Шляхом поставлення у відповідність світлових стимулів з довжиною хвиль 600 і 730 нм до і після підвищення температури, де Фріз виявив 5 % зміну фотопічної (колбочкової) чутливості до далекої червоної області спектру (730 нм). Для пояснення цього ефекту де Фріз висунув гіпотезу, що фотопігмент, який максимально чутливий до довгохвильового світла (фотонів з низькою енергією) має відносно малий поріг для активації, а відтак має більшу ймовірність для теплової ізомеризації. З іншого боку, фотопігменти, чутливі до коротких хвиль світла, характеризуються високою енергією активації і тому є більш стабільними. Тож, чутливість зору не може сягати далі, інфрачервоний діапазон спектру, оскільки це призведе до збільшення теплової активації фотопігменту і хибного сигналізування сприйняття світла. В цілому, де Фріз прийшов до висновку, що самої теплової енергії достатньо для активації зорового пігменту.
Г.Барлоу вперше експериментально виявив та пояснив вплив «темрявного світла» на нічний, паличковий зір, використавши розроблений Волтером Стайлсом та колегами психофізичний метод «двоколірного порогу приросту» (англ. two-color increment threshold) — поріг видимості для спалахів малого тестового світла (приріст) на великому, постійно освітленому фоні, до якого спостерігач є адаптованим ( т.зв. адаптація до фонового світла ).
Метод «порогу приросту» полягає у використанні висхідного тестового стимулу (ΔI) на великому адаптивному фоні (I). Яскравість тестового стимулу збільшується допоки не буде досягнуто порогу виявлення стимулу спостерігачем відносно фону. Після визначення порогу інтенсивність фону збільшується і вимірювання порогу знову повторюється. По суті, це подібно до виявлення малого, низькоконтрастного об'єкту (напр. птаха) на фоні яскравого неба, яке спостерігач споглядав достатньо довго, щоб адаптуватись до нього. Тому поріг приросту (ΔI) також називається «ледь помітна різниця» (англ. Just-noticeable difference) або «поріг розрізнення», оскільки нижче нього світловий стимул не можна виявити або розрізнити від фону.
Процедура вимірювання порогу приросту виконується для рівнів фонового світла в діапазоні від темряви до яскравого денного світла, завдяки чому можна отримати моно- або двофазну «tvi криву» (англ. threshold versus intensity curve) адаптації до світла, яка показує залежність зміни порогу (ΔI) від фонової інтенсивності (I) як для паличкового, так і для колбочкового зору. Головною перевагою методу приросту порогу у порівнянні з класичним методом «порогу розрізнення» (англ. difference threshold) є можливість виявити, шляхом зміни довжини хвиль освітлення фону та висхідного стимулу, майже незалежних компонент в загальному відношенні ΔI до І, що належать як паличкам так і колбочкам. Кожен з цих окремих компонент показує більш просте відношення ΔI до І, аніж ціле око.
В експерименті порогу приросту, коли потрібно ізолювати лише паличкову систему, використовується довгохвильовий адаптивний (червоний) фон для придушення колбочок та короткохвильова (синя) тестова точка для стимуляції паличок. Такий експеримент допоміг Барлоу виявити в tvi кривій чотири відмінні сегменти.
Перший, лінійний сегмент (для якого нахил кривої, m, на графіку в подвійному логарифмічному масштабі, m = 0) tvi кривої включає діапазон рівнів інтенсивності світла, де поріг виявлення обмежений внутрішньоклітинним фоторецепторним шумом і тому незалежний від фону. В цьому діапазоні фон постає майже чорним (однак не цілком чорним, а те, що німецькі психологи 19 ст. назвали «внутрішнім сірим» (нім. Eigengrau), який «видимий» в цілковитій темряві або коли закрити очі) і фоторецепторний шум генерує стільки ж «темрявного світла», скільки фон — справжнього світла. Оскільки світлова чутливість тут обумовлена темрявним світлом, то зростання фонової інтенсивності не призводить до зростання порогу виявлення.
Другий сегмент кривої, з кутом нахилу m = 1/2, описує квантові коливання (внаслідок випадкового характеру надходження фотонів до сітківки) фонової інтенсивності. Фон настільки тьмяний, що коливання притаманні світловому джерелу, який їх генерує, відіграє ключову роль у покладанні порогу виявлення. Відтак, поріг в цьому сегменті кривої збільшується з квадратним коренем фонової інтенсивності. Таке відношення порогу приросту до фонової інтенсивності описується «законом де Фріза-Роуза» (англ. de Vries-Rose Law), також відомим як «закон квадратного кореня»:
-
.
Для виявлення стимулу в цьому діапазоні він повинен достатньо різнитись від фону, щоб перевершити квантові коливання.
Найбільший сегмент tvi-кривої (покриває діапазон 4 логарифмічних одиниць) має кут нахилу m = 1, що означає пропорційність зростання порогу з фоновою інтенсивністю — відношення, відоме, як закон Вебера. Відповідно до закону Вебера, із збільшенням яскравості фону, інтенсивність порогу приросту має бути збільшена настільки, щоб відношення інтенсивності порогу приросту (ΔI) до фонової інтенсивності (I) залишалось сталим:
-
.
де k — стала Вебера або дріб Вебера. Порогова інтенсивність, ΔI,також відома як «ледь помітна різниця» — мінімально помітна зміна в інтенсивності.
В останньому, верхньому сегменті кривої кут нахилу прямує до нескінченності, m = ∞. Це свідчить про насичення паличок при високих рівнях фонової інтенсивності. За таких рівнів фонового освітлення паличкова система вже не в змозі виявити приріст стимулу, незалежно від рівня його інтенсивності, бувши придушена яскравістю фону. Насичення паличок трапляється коли сила світла досягає ~6 кд/м2. В цьому діапазоні відбувається знебарвлення всього лише 10 % фотопігменту родопсину, що однак є достатнім для закриття Na+-каналів і придушення циркулівного струму, призводячи до гіперполяризації паличок. На відміну від паличок, колбочки не насичуються і характеризуються сталим порогом розрізнення для надзвичайно великого діапазону фонових інтенсивностей.
Ідея темрявного світла була висунута Барлоу для пояснення виявленого ним факту, що справжнє фонове світло призводить до зростання зорового порогу тільки починаючи із певної світлової інтенсивності, а дуже тьмяний фон не міг перевершити внутрішнє «світло», притаманне самій зоровій системі. Тож «темрявне світло» діє як справжнє фонове світло, встановлюючи зоровий поріг виявлення зміни інтенсивності стимулу. Використавши метод порогу приросту, Барлоу встановив, що значення «темрявного світла» коливаються в діапазоні 0,004-0,11 події темрявного світла/с−1. Подальші психофізичні експерименти оцінили частоту темрявного світла для паличок людини в 0,011 подій темрявного світла/(с·паличку), а для колбочок в центральній ямці — 112 подій темрявного світла/(с·колбочку).
Темрявний шум в паличках
Більше співвідношення сигнал/шум паличок у порівнянні з колбочками частково пов'язане з надзвичайною стабільністю паличкового фотопігменту родопсину в темряві відносно спонтанної теплової активації. Така темрявна стабільність родопсину пояснює, чому для його ізомеризації потрібні фотони зі значною енергією, близькою до його максимального поглинання.
Однак оскільки паличка містить 108−1010 молекул родопсину, то в темряві все ж можлива спонтанна теплова ізомеризація родопсину, хоч і не часто. Електрофізіологічні дослідження переконливо показали, що спонтанна теплова ізомеризація є визначальним джерелом шуму паличок приматів. Відтак, на найнижчих рівнях світла саме тепловий шум, а не шум який виникає після активації фотопігменту в процесі фототрансдукції, накладає обмеження на ефективність зорової системи.
У фоторецепторах хребетних темрявне світло[уточнити] вперше було виявлене в паличках in vitro в 1980-х роках. Оскільки палички повинні виявляти одиничні фотони за низького рівня освітлення, то теплова активація паличкового фотопігменту родопсину є дуже рідкісною, він є надзвичайно стабільним за відсутності світла. Проте спонтанні теплові події можна виявити через електричні сигнали, які вони генерують у паличці. Теплова активація родопсину первинно була виявлена в електрофізіологічних експериментах як дискретний шум паличок, адаптованих до темряви.
Вимірювання мембранного струму зовнішнього сегмента палички ропухи аги в темряві виявило (серед >109 молекул родопсину) спонтанні дискретні «стрибки», що були схожими на відповіді палички на одиничні фотони. При 20°С частота активації родопсину ропухи складала 10−11с−1 на молекулу, що в середньому відповідає 1 спонтанній ізомеризації на ~2000 років. Схожі дискретні темрявні стрибки були виявлені в паличках макаки, частота яких (~0,01 теплових ізомеризацій/(с·паличку)) досить добре узгоджується з отриманими Барлоу психофізичними оцінками внутрішнього шуму паличкової системи зору людини. Враховуючи, що паличка ссавців містить 108 молекул родопсину, кожна з них активується спонтанно раз на 300 років при 37°С.
Психофізичні дані відмінно узгоджуються з електрофізіологічними також для паличкової системи миші. Вимірюване через поріг приросту темрявне світло миші точно відповідає частоті (0,012 R*/(с·паличку) при 36°С) спонтанної теплової активації родопсину, реєстрованої в паличках миші. Це підтверджує гіпотезу Барлоу, що така спонтанна теплова ізомеризація є джерелом шуму, який обмежує адаптовану до темряви зорову систему.
Дослідження темрявного шуму в паличках миші свідчать, що родопсин еволюціонував під великим тиском природного добору мінімізувати його спонтанну теплову активацію, позаяк частота 0,012 R*/с−1/паличку−1 відповідає внутрішній частоті 1,7 x 10−10/с−1/молекулу родопсину в популяції 7 x 107 молекул родопсину на одну паличку. Тобто, молекула родопсину миші спонтанно ізомеризується кожні ~200 років.
Трансмембранний струм, генерований внаслідок теплової ізомеризації родопсину, не різниться від струму, генерованого ізомеризацією внаслідок поглинання фотонів. Відмінність відгуку одиничної молекули родопсину на світло й теплову активацію полягає лише в частоті цих відгуків, які у відповідь на світло постають з частотою, обумовленою швидкістю надходження фотонів. Тоді як частота теплових ізомеризацій обумовлена температурою та кількістю молекул родопсину на одну паличку. До прикладу, в паличці жаби при кімнатній температурі одна молекула родопсину (із 109) активується теплом кожні 50 с.
Оскільки філогенетичний аналіз показує, що паличковий фотопігмент родопсин еволюціонував із колбочкових фотопігментів і частота спонтанної ізомеризації родопсину в тисячу разів менша, ніж колбочкових пігментів, це свідчить про те, що зменшення частоти дискретного темрявного шуму в паличках було одним з ключових кроків у еволюції стабільних зорових пігментів, здатних виявляти одиничні фотони.
Вплив протонування основи Шиффа
Ключовим для розуміння темрявного шуму у фотопігменті палички було відкриття в паличках ропухи аги досить низького енергетичного бар'єра Арреніуса для теплової ізомеризації хромофору родопсину — 22 ккал/моль. Такий низький бар'єр теплової активації міг вказувати на те, що фотоактивація зорового пігменту йде відмінним від теплової ізомеризації шляхом, оскільки ентальпія основного стану первинного продукту фотоізомеризації родопсину (батородопсину) складає ~35 ккал/моль.
Для пояснення розбіжності між фотонним та тепловим енергетичними бар'єрами активації родопсину американські хімік Роберт Бірдж (англ. Robert R. Birge) та фізіолог Роберт Барлоу Мол. (англ. Robert B. Barlow Jr.) висунули припущення, що механізм теплової ізомеризації повинен різнитись від фотоізомеризації хромофору та якимось чином оминати формування батородопсину. Зокрема, на основі теоретичних обчислень та експериментів з фоторецепторами мечохвостів (Limulus), Бірдж та Барлоу висунули гіпотезу, що низька частота теплової ізомеризації паличок пов'язана із високим pK основи Шиффа (з'єднує хромофор ретиналь із залишком лізину296, розміщеного в сьомій трансмембранній α–спіралі опсину) родопсину. pK шиффової основи бичачого родопсину є дуже високим, >15 (), тоді як, до прикладу, pK родопсину восьминога та колбочки гекона значно менший — 10,4 і 9,9, відповідно.
Модель Бірджа-Барлоу передбачала, що дисоціація протону від протонованої основи Шиффа 11-цис-ретиналю (ПОШ11) повинна призводити до зменшення бар'єру для теплової ізомеризації. Оскільки протоновані основи Шиффа родопсину мають високий pK, то лише незначна частина родопсинів буде ізомеризована. Тому вищий pK родопсину повинен бути пов'язаний із зменшенням ймовірності депротонування шиффової основи, яке, згідно з моделлю, призводить до швидшої ізомеризації ретиналю довкола C11=C12 подвійного зв'язку і таким чином до більш швидкого теплового формування все-транс продукту, який фоторецептор сприйме як активований родопсин. Модель припускала, що депротонування основи Шиффа призведе до зниження енергії активації для ізомеризації хромофору із ~45 ккал/моль до необхідних ~23 ккал/моль.
Втім, всупереч моделі Бірджа-Барлоу, формування депротонованої шиффової основи повинно приводити до зменшення, не збільшення, ймовірності теплової ізомеризації. Крім того, подальші дослідження родопсину паличок жаб та L-колбочок саламандр не підтвердили припущення цієї моделі про сильну залежність теплової активації фотопігменту від pH. Тож, хоча модель Бірджа-Барлоу вдало передбачала спонтанну активацію фотопігменту паличок мечехвостих, вона була не в змозі пояснити механізм теплової ізомеризації фотопігментів інших хребетних.
Зв'язок між тепловою та фотохімічною активацією родопсину
Модель Бірджа-Барлоу припускала, що а) оскільки бар'єр теплової ізомеризації фотопігменту становить 22 ккал/моль, б) фотохімічна енергія активації 40-50 ккал/моль і в) первинний фотопродукт знаходиться на 32 ккал/моль вище родопсину, то теплова та фотохімічна ізомеризація фотопігменту реалізуються окремими шляхами і не пов'язані між собою. Однак існує ряд свідчень, що теплова ізомеризація пов'язана із фотохімічною. Зокрема, фоторецепторний сигнал, викликаний внаслідок теплової активації схожий на сигнал, викликаний поглинанням фотону. Окрім того, як і фотоізомеризація, теплові процеси призводять до ізомеризації хромофору довкола C11=C12 зв'язку без значної зміни вторинної структури опсину.
Відповідно до гіпотези Барлоу між довжиною хвилі максимального поглинання (λmax) та кінетичною сталою теплової активації (k) зорового пігменту повинен існувати зв'язок («кореляція Барлоу»), такий що –logk обернено пропорційний 1/λmax. Підтвердження кореляції Барлоу було отримане в експерименті, в якому вимірювалась енергія активації для 12 зорових пігментів (як паличок, так і колбочок) з різними довжинами хвиль максимального поглинання (λmax). Як і передбачала гіпотеза Барлоу, було виявлено, що енергія активації Ea спадає зі зміщенням λmax від короткохвильового (синього) до довгохвильового (червоного) спектру. Однак в цьому експерименті червоне зміщення λmax супроводжувалось менш сильним спаданням в Ea, аніж передбачена Барлоу залежність від 1/λmax.
Перше механістичне підтвердження кореляції Барлоу було запропоноване в дослідженні Ло та ін., де була показана кореляція рівня темрявного шуму з максимумом поглинання фотопігменту. Ло та ін. припустили, що отриманий в ранніх дослідженнях бар'єр теплової активації 22 ккал/моль не є точним, оскільки вимірювався на основі больцманівської статистики, яка включає тільки одну молекулярну моду коливання і як було показано в попередніх обчисленнях та експериментах, не підходить для опису мономолекулярних реакцій в реактантах з багатьма внутрішніми ступенями свободи, як в молекулі родопсину.
Використовуючи статистичну механіку множинних мод коливання Гіншелвуда і Р.Джорджа, Ло та ін. запропонували макроскопічну фізико-хімічну теорію, відповідно до якої активація фотопігменту світлом та теплом проходить через один і той же енергетичний бар'єр основного стану для ізомеризації (Ea), тим самим пояснюючи кореляцію між темрявним шумом фотопігменту та λmax.
Вплив електронної структури хромофору на темрявний шум
Теорія Ло та ін. передбачала, що темрявний шум фотопігменту внаслідок теплової активації постає, подібно до фотоізомеризації, із канонічної ізомеризації. Однак нещодавні дослідження на основі квантово-механічних обчислень прийшли до іншого висновку.
Використовуючи комбінований метод квантової та молекулярної механіки (QM/MM ) для моделювання родопсину, в дослідженні С.Гозема та ін. було показано, що механізм теплової ізомеризації протонованої основи Шиффа 11-цис-ретинлю (ПОШ11) в родопсині різниться від фотохімічної ізомеризації. Унікальність цього дослідження полягає в тому, що кореляцію Барлоу вдалось передбачити на основі лише теоретичних, квантово-механічних обчислень, які дозволили прийти до нових висновків про вплив темрявного шуму на фотопігмент для різних довжин хвиль.
Гозем та ін. трактували фотохімію зору в термінах поверхні потенціальної енергії (ППЕ) — 3N-вимірна гіперповерхня, що відображає повну енергію N атомів, як функцію положень атомів. В цьому контексті відмінність між фотохімічною та тепловою реакцією полягає в тому, що остання ініціюється теплом і реактант відокремлений від продукту перехідним станом, що знаходиться на тій же самій, одиничній поверхні потенціальної енергії (адіабатичний процес). Тоді як процес фотохімічної реакції, яка ініціюється світлом, відбувається на двох і більше поверхнях потенціальної енергії.

До поглинання фотону молекула знаходиться в стані з найменшою енергією — основному стані (S0, якщо це синглетний стан), коли всі електрони займають найнижчі можливі орбіталі. Оскільки електрони дуже легкі і мають незначну масу у порівнянні з ядром, то, відповідно до принципу Франка-Кондона, поглинання світла приведе їх у миттєвий рух. Відтак, поглинання фотону, зберігаючи ядерну геометрію, рухає хромофор від електронно-основного стану, S0, до електронно-збудженого стану Sn (т. зв. «вертикальне збудження»), де електрони рухаються в орбіталях вищої енергії, ефективно поглинаючи і зберігаючи енергію. Фотохімічні перетворення зору відбуваються через серію простих кроків — «первинних процесів», в яких продукт фотохімічної реакції формується безпосередньо із збудженого стану реактанту (напр., цис-транс ізомеризація ретиналю). Такі фотохімічні процеси, які генерують фотопродукт прямо зі збудженого стану без випромінювання, називаються неадіабатичними. Ці процеси можливі завдяки існуванню між ППЕ перетинів, які створюють нову топологічну властивість — конічний перетин, де дві взаємодійні ППЕ мають однакову мультиплетність. Конічний перетин діє як лійка, поєднуючи енергетичні поверхні збудженого та основного стану, тим самим забезпечуючи ефективний розпад реактанту до основного стану та формування фотопродукту. Тож, конічний перетин, визначаючи шлях між електронними станами, дозволяє хромофорам надзвичайно швидко розсіювати надлишкову поглинену енергію, без чого хімічні зв'язки розриватимуться, призводячи до формування небажаних хімічних фрагментів. Саме з існуванням конічного перетину між ППЕ основного і збудженого електронних станів пов'язане надшвидке та ефективне перетворення енергії фотону в хімічну енергію в процесі ізомеризації родопсину.
QM/MM-обчислення і моделювання Гозема та ін. показали, що теплова ізомеризація ПОШ11 цілком слідує шляхом основного стану (S0) і контролюється енергетичним бар'єром (Ea), що відповідає S0-перехідному стану (ПС). Поверхня потенціальної енергії основного стану ПОШ11 характеризується двома ПС, які контролюють одну і ту ж теплову ізомеризацію: ПСДИР (дирадикал) та ПСПЗ (переніс заряду). Існування двох ПС пов'язане із наявністю між ними конічного перетину, що було експериментально підтверджено для родопсину з використанням надшвидкої оптичної спектроскопії.
Здійснені Гоземом та ін. QM/MM-обчислення на основі методу багатоконфігураційного самоузгодженого поля для бичачого родопсину показали, що в ПСДИР розподіл зарядів корелює із розподілом зарядів S0 ПОШ11-реактанту і +0,98 e його заряду розміщено в області шиффової основи. Тоді як більшість заряду ПСПЗ (+0,90 e) знаходиться в області β-іононового кільця, що значно більш подібне до розподілу заряду вертикально збудженого S1 стану ПОШ11. Вертикальне збудження ПОШ11 в родопсині призводить до перенесення ~30 % позитивного заряду із шиффової основи до β-іононової частини хромофору. Обчислена енергія активації для ПСПЗ ~34 ккал/моль і знаходиться на 11 ккал/моль нижче ПСДИР. Відтак, ПСПЗ цілком контролює теплову ізомеризацію ПОШ11.
Відповідно до теореми Герцберга-Лонге-Хіггінса (1963) електронні хвильові функції двох станів, які переходять конічний перетин в конфігураційному просторі, змінюють геометричну фазу (фаза Беррі) і після повернення до вихідної точки, це фазове зміщення призводить до зміни знаку функції. Тому коли молекула рухається вздовж замкненого контуру (петлі) довкола одиничної точки конічного перетину, її електронні хвильові функції станів зазнають змін. Подібна поведінка обчислювально була показана для ПОШ11. Розподіл зарядів змінюється двічі вздовж петлі довкола перетину і ділить S0 ППЕ на дві області: в першій області хромофор має позитивний заряд, розміщений на сегменті шиффової основи і має хвильову функцію (ΨДИР), схожу до такої ж родопсину в його основному стані (S0); в другій області заряд знаходиться на протилежному сегменті і має хвильову функцію (ΨПЗ), подібну до такої ж родопсину в його збудженому стані (S1). Відтак, виявлені Гоземом та ін. структури ПСДИР і ПСПЗ, розміщені на протилежних сторонах конічного перетину, є проявами геометричної фази. З цього випливало, що послідовності опсину зорового пігменту, які стабілізують позитивний заряд в області основи Шиффа, призведуть до зміщення λmax в синій кінець спектру, тоді як послідовності, що стабілізують заряд в β-іононовій частині ретиналю призводитимуть до зміщення λmax в червоний кінець.
На основі отриманих результатів, Гозем та ін. прийшли до висновку, що існування темрявного шуму в паличках пов'язане із двома електронно-відмінними перехідними станами ПОШ11. Подібність електронної структури нижчого з цих перехідних станів, ПСПЗ, до збудженого S1-стану ПОШ11, пояснює прямий зв'язок між вертикальною енергією збудження (ΔS1 — S0) і стабільністю ПС (енергетичним бар'єром, Ea), що, у свою чергу передбачає існування прямого зв'язку між –logk та 1/λmax. Тож, якщо ПСПЗ контролює бар'єр теплової ізомеризації (тобто, якщо цей перехідний стан нижчий в енергії, ніж інший перехідний стан, ПСДИР), то це може бути природним поясненням кореляції Барлоу, механістична основа якої знаходиться в електричних властивостях ПОШ11 родопсину.
Таким чином, теорія Гозема та ін. показала, що кореляція Барлоу постає як результат геометричної фази — фундаментальної властивості електронної хвильової функції хромофору в області конічного перетину, без якого теплова ізомеризація контролювалась б ПСДИР-бар'єром, що призводило б до підвищеної зорової чутливості не в синьому кінці видимого спектра (як то характерно для зору), а в червоному. В такий спосіб кореляція Барлоу поєднує біологію зору із молекулярною фізикою на фундаментальному рівні.
Анти-Барлоу кореляція і синє зміщення λmax
Теорія Гозема та ін. передбачала, що для зорових пігментів, які максимально поглинають світло з довжинами хвиль коротшими ніж 470 нм, справедливою є «анти-Барлоу кореляція» (не зростання, а убування –logk залежно від 1/λmax). Згідно з цими передбаченнями, найвища зорова чутливість зору повинна досягатись в зелено-синьому кінці спектру, поза яким неможливе подальше зменшення темрявного шуму, оскільки ПСДИР контролюватиме теплову ізомеризацію для λmax нижче 470 нм в анти-Барлоу спосіб. Ці передбачення узгоджуються з максимальною чутливістю фотопігменту паличок до зелених-синіх довжин хвиль, а також зі ефектом Пуркіне — в темряві (під час сутінок та вночі) сині об'єкти більш видимі для зору, аніж червоні, які постають чорними.
Нещодавно передбачення існування анти-Барлоу кореляції отримали підтвердження в дослідженні родопсинів паличок бабцевидних риб, що активні на різних глибинах озера Байкал. Зорові пігменти паличок і колбочок цих риб характеризуються поступовим зміщенням довжини хвилі максимального поглинання (λmax) в синій кінець спектру. λmax родопсину зміщується від 516 нм у видів на поверхні до 484 нм у видів на найбільших глибинах. Таке синє зміщення λmax пов'язане із варіаціями амінокислот, що взаємодіють із хромофором. Довгий час вважалось, що притаманна родопсинам глибоководних риб λmax = 470—480 нм постала як адаптація до панівного на глибині синього світла. Однак таке припущення нехтує такою важливою функцією родопсину, як фоточутливість, що може бути більш важлива на тьмяно освітленій глибині озера Байкал. Тому альтернативна гіпотеза припускає, що синє зміщення λmax родопсину бабцевидних риб може бути пов'язане з виявленим Барлоу відношенням між частотою спонтанної теплової ізомеризації та довжиною хвилі максимальної чутливості. Ця гіпотеза постулює, що у відповідності з анти-Барлоу кореляцією, синє зміщення λmax родопсинів глибоководних риб пов'язане з необхідністю зменшити шум в середовищі з низькими інтенсивностями світла.
Поєднавши методи порівняльного моделювання білків і QM/MM-обчислень з in vitro вимірюваннями родопсинів чотирьох видів бабцевидних риб, дослідникам вдалось підтвердити справедливість анти-Барлоу кореляції для цих видів. Зокрема, було показано існування залежності між λmax (вираженою як вертикальна енергія збудження хромофору (ΔE)) та частотою ізомеризації, пов'язаною з енергією активації хромофору (Ea). Побудовані моделі дозволили виявити, що у філогенетично близьких родопсинах варіація ΔE та Ea керується електростатичними властивостями білка. Крім того, було ідентифіковано 8 замін (із 20) амінокислот родопсину, які модулюють чутливість до світла від «червоно-зміщених» видів бабцевидних (Paracottus kneri) до «синьо-зміщених» (Abyssocottus korotneffi).
З цього дослідження випливало, що синє зміщення λmax, і відповідно зменшення темрявного шуму, могло еволюціонувати у родопсинах глибоководних риб Байкалу як побічний результат адаптації до надзвичайно низького рівня освітлення. Навіть більше, результати свідчили про те, що принаймні для риб Байкалу два ключові аспекти функціювання зорового пігменту (частота ізомеризації, що визначає величину теплового шуму, і λmax) є взаємозалежними. Тому в цих риб еволюціонували заміни амінокислот родопсинів, які регулюють обидві ці величини одночасно для адаптації, яка покращить фоточутливість і уможливить активність на глибині Байкалу в тьмяному середовищі зі світлом, зміщеним в синій кінець спектру.
Темрявний шум в колбочках
На відміну від паличок, в колбочках темрявний шум є значно більшим, тому і поведінкові пороги виявлення стимулу колбочковим зором є вищими. Із високою спонтанною тепловою ізомеризацією хромофору паличок пов'язана наявність в колбочці великої кількості опсину, позбавленого зв'язаного хромофора. Такий апо-пігмент здатен активувати фототрансдукцію і частково може пояснити чому для колбочок характерний швидший відгук на світло, аніж для паличок.
Гіпотеза Барлоу припускає, що вищий шум колбочкового зору може бути пояснений більшою частотою теплової активації фотопігменту L колбочки: теплові коливання спричинятимуть вищу частоту спонтанної активації фотопігментів, які поглинають фотони з довгими довжинами хвиль (напр.., фотопігмент L колбочки), аніж фотопігментів які поглинають фотони з короткими хвилями (фотопігмент S-колбочок). Здійснені в кінці 1970-х рр. внутрішньоклітинні вимірювання мембранного потенціалу L-колбочки черепахи виявили високий рівень шуму в колбочкових фоторецепторах. Завдяки міжрецепторним електричним поєднанням через щілинні контакти (див. детальніше) амплітуда такого шуму зменшується через усереднення колбочкових сигналів. Однак в електрично-ізольованих колбочках, що не мають щілинних контактів із сусідніми фоторецепторами, амплітуда темрявного струму (~3000 мкВ від піка до піка) є надзвичайно великою у порівнянні з амплітудою відгуку колбочки на одиничний фотон (25 мкВ), унеможливлюючи подібну до паличок чутливість колбочок до одиничних фотонів.
На основі внутрішньоклітинної реєстрації L і M-колбочок макаки було обчислено, що темрявний шум цих колбочок еквівалентний >3000 ізомеризацій/(с·колбочку). З іншого боку, в саламандр (Амбістома тигрова) L-колбочки мають значно більший шум, ніж S-колбочки, що, у відповідності з гіпотезою Барлоу, свідчить про залежність частоти темрявного шуму від 1/λmax.
Особливою рисою L і M-колбочок, що різнить їх від паличок, є неперервність шуму. Оскільки опсин L-колбочок значно менш стабільний, аніж опсини M- та S-колбочок, то теплова активація фотопігменту цих колбочок є головним джерелом їх темрявного струму. Так, в L-колбочках саламандри неперервний темрявний шум виникає зі спонтанної теплової ізомеризації їх фотопігменту, частота якого значно вища (~1000 ізомеризацій/с при 20С), ніж в паличках саламандр (~0,03 ізомеризацій/с при 20С). Амплітуда шуму в темрявному струмі L-колбочки є значно більшою, аніж M-колбочок, що свідчить про меншу фоточутливість L-колбочок у порівнянні з M-колбочками. Зокрема, в сітківці морського окуня, подвійні L-колбочки є в 40 разів менш чутливими до світла, ніж M-колбочки. Темрявний шум S-колбочок саламандр, на відміну від L-колбочок, менше пов'язаний із тепловою ізомеризацією хрофомору і скоріш за все постає на нижчих рівнях фототрансдукції, оскільки часові характеристики цього шуму різняться від відгуку на тьмяне світло.
В оригінальному експерименті, де палички шпоркової жаби були генетично трансформовані для експресії людського опсину L-колбочок і їх колбочки модифіковані для експресії родопсину, було вперше показано активацію одиничної молекули колбочкового фотопігменту і продемонстровано відношення між λmax опсинів, темрявним шумом і фоточутливістю. Фотореакція таких трнасгенних паличок була подібна до звичайних паличок, що свідчило про те, що опсини колбочок здатні залучати паличкові ферменти трансдукції. Однак ці палички були менш чутливі та характеризувались більшим темрявним шумом, аніж звичайні палички, вказуючи на те, що їх фоточутливість та шум темрявного струму обумовлені нестабільним опсином L-колбочки. Завдяки цьому вдалось визначити частоту спонтанної теплової активації зорових пігментів L-колбочки, що має відгук, подібний до активації одиничним фотоном. Зокрема, було встановлено, що частота теплової активації в 10 000 разів вища для фотопігменту L-колбочок, аніж для фотопігменту палички. Відтак, в L-колбочках шпоркової жаби в темряві відбувається ~200 активацій фотопігменту/с. Такий рівень темрявного шуму близький до загального рівня темрявного шуму в L-колбочках саламандри, підтверджуючи, що цей шум постає із теплової активації фотопігменту. Подібна спонтанна активність діє як фонове світло, яке викликає адаптацію L-колбочок і, як наслідок, десенсибілізацію та прискорення відгуку на спалах світла. Ці експерименти з експресією колбочкового фотопігменту в паличці, який призводить до збільшення їх темрявного шуму, підтвердили, що теплова ізомеризація хромофору зорового пігменту відповідальна за більшу частину фоторецепторного шуму.
Наслідком високої частоти теплової активації фотопігменту L-колбочок земноводних є притаманна їм постійна активність каскаду фототрансдукції навіть в темряві. Тому L-колбочки земноводних постійно перебувають під «темрявним світлом», що формує в них адаптацію та сприяє їх меншій чутливості та швидкій кінетиці реакції у порівнянні з паличками. На відміну від земноводних, фотопігмент L-колбочок людини експресований в паличках миші має частоту ~10 спонтанних ізомеризацій/с−1/колбочку. Хоча це в ~1000 разів вища частота, аніж родопсину миші, це в ~40 нижча частота від родопсину паличок земноводних. Одна з можливих причин такої відмінності пов'язана з різними хромофорами у фотопігментах мишей (11-цис-ретианль, або А1) та земноводних (11-цис-3-дегідроретиналь, або А2).
Запропонована Ло та ін. макроскопічна фізико-хімічна теорія однією з перших змогла механістично пояснити залежність частоти шуму колбочок від λmax і збільшення шуму в 107-разів від S- до L-колбочкового фотопігменту. Відповідно до цієї теорії та здійсненими вимірюваннями темрявного шуму, Ло та ін. показали, що колбочковий фотопігмент у 25 разів більш спонтанно активний, аніж паличковий. Найпростішим поясненням цього може бути те, що фотопігмент колбочок має вищу молекулярну частоту переходу бар'єру енергії активації. Однак існує й інше пояснення. Опсини паличок мають «закриту» білкову кишеню зв'язування хромофору, завдяки чому паличковим хромофорам притаманна висока теплова стабільність, хоча і в обмін на повільний обмін хромофору і, як наслідок, повільніше відновлення після знебарвлення. Можливі молекулярні шляхи теплової ізомеризації хромофору палички сильно обмежені опсином. На відміну від паличок, хромофорна кишеня колбочкових пігментів є «відкритою» до зовнішньої води, уможливлюючи швидкий обмін хромофору і, як наслідок, швидше відновлення після знебарвлення. В деяких пігментах колбочок присутній безперервний обмін хромофору навіть в темряві, вказуючи на слабший контроль опсином ніж в паличках. Тож «відкритість» пігментової кишені колбочки може накладати менше обмежень на спонтанну ізомеризацію хромофору, тим самим обумовлюючи вищий тепловий шум колбочок для даної λmax у порівнянні з паличками.
В цілому, теорія Ло та ін. пояснює чому фотопігменти з λmax в далекому червоному та інфрачервоному діапазоні спектру не були виявлені і скоріш за все неможливі у природі через їхній надлишковий тепловий шум.
Темрявний шум фототрансдукції
Окрім дискретного шуму, обумовленого тепловою активацією фотопігменту, у фоторецепторах в темряві також наявний неперервний шум, що виражається у стійкому коливанні темрявного струму. В адаптованих до темряви паличках жаб цей шум постає спонтанно, з середньою частотою ~6000 хибних схоплень фотону/с.
В паличках неперервна складова темрявного шуму формується із компонентів різної частоти. Високочастотний неперервний шум постає внаслідок спонтанного відкриття цГМФ-регульованих каналів, тоді як низькочастотний шум — через коливання концентрації цГМФ внаслідок спонтанної активності фосфодіестарази. Щодо шуму внаслідок стохастичної поведінки цГМФ-регульованих каналів, то він має незначний вплив, оскільки відфільтровується мембранною часовою сталою і робить внесок до темрявного струму тільки при значно вищих частотах, аніж частота фотовідгуку рецептора.
Ферментативна активність ФДЕ в темряві коливається відносно її середнього значення, призводячи до коливань в концентрації цГМФ. Тому генерований внаслідок цього шум темрявного струму є неперервним в часі й зі спектром, відмінним від сигналу, викликаного світлом. В паличках середньоквадратична амплітуда шуму струму генерованого спонтанною активацією ФДЕ є набагато меншою (~0,035 пА), аніж середньоквадратична амплітуда сигналів, генерованих одиничною молекулою родопсину (~1 пА). Саме тому відгук родопсину на одиничний фотон різниться від неперервного шуму та може бути виявлений індивідом.
Шум, пов'язаний із стохастичною активністю ФДЕ також притаманний колбочкам. Порівняння шуму фототрансдукції в L- і S-колбочках саламандри, виявило що шум в L-колбочках обумовлений головним чином тепловою ізомеризацією їх фотопігменту. Однак в S-колбочках саме ФДЕ-активація відповідальна за їх шум фототрансдукції. Так само порівняння шуму в колбочках приматів виявило, що панівним у шумі фототрансдукції є шум внаслідок теплової ізомеризації, а шум від цГМФ-регульованих каналів та коливань концентрації цГМФ через стохастичну поведінку ФДЕ.
В M-колбочках опсин майже такий же стабільний, як родопсин. Однак фотовідгук одиничного опсину M-колбочки є значно меншим (~0,08 пА для морського окуня), аніж амплітуда шуму струму, генерованого стохастичною активацією ФДЕ (~0,28 пА). Тому в M-колбочках морського окуня головним джерелом шуму в темрявному струмі є коливання активності ФДЕ. Передбачається, що тільки коли щонайменше 3-4 молекули фотопігменту будуть збуджені одночасно в M-колбочках, генерований сигнал буде виділятись на фоні неперервного шуму.
Той факт, що шум темрявного світла, який сприймає людина в класичних психофізичних експериментах, наближається до частоти теплової ізомеризації родопсину, свідчить про те, що шум внаслідок ФДЕ загалом відфільтровується в синапсах.
Міжрецепторні електричні з'єднання
Окрім з'єднань між фоторецепторами та постсинаптичними нейронами через хімічні синапси що формують первинний шлях передачі рецепторних сигналів, існують також з'єднання між самими фоторецепторами через електричні синапси, які забезпечують вторинний шлях для рецепторних сигналів.
Прямі міжрецепторні контакти спершу були показані (1958 р.) між аксонами колбочок та паличок в зовнішньому сітчастому шарі сітківки морської свинки. Згодом схожі контакти між відростками паличок і колбочок та колбочка-колбочка були виявлені в сітківці голуба, людини, макаки та вивірки сірої.
В серії анатомічних та фізіологічних досліджень було переконливо показано, що в основі електричних міжрецепторних з'єднань є щілинні контакти між синаптичними терміналами сусідніх фоторецепторів, завдяки яким здійснюється двонапрямна пряма передача сигналів між прилеглими рецепторами В колбочках щілинні контакти найчастіше знаходяться на закінченнях дуже тонких відростків, телодендрій, які відходять від основи аксонних ніжок та формують контакти з сусідніми колбочками. Контакти між телодендріями прилеглих колбочок формуються через конексинні (Cx36) канали щілинних контактів, завдяки яким колбочки є електрично поєднаними. Ближче до центральної ями сітківки хребетних, аксонні ніжки колбочок щільно розміщені одна до одної та поєднані через телодендрії, які розходяться в бік від аксонних терміналів.
Аксонні закінчення паличок ссавців не мають телодендріїв, але з ними контактують телодендрії з аксонних закінчень колбочок. Одна сферула палички може містити від 3 до 5 щілинних з'єднань від телодендрій прилеглої колбочки і одна ніжка колбочки може мати до 10 контактів із сусідніми паличками.
Завдяки електричному міжрецепторному поєднанню зміна в потенціалі одного фоторецептора може поширитись на прилеглі фоторецептори. Вплив щілинних контактів на електричну активність одиничних фоторецепторів вперше був показаний на прикладі колбочок сітківки черепахи, які були освітлені малими (радіус 4 мкм) і великими (радіус 70 мкм) точками світла з однаковою інтенсивністю. Тоді як мала точка освітлювала лише одну колбочку, велика освітлювала також сусідні колбочки. Як наслідок, освітлення більшими точками світла призводило до більшої гіперполяризації колбочок, аніж меншими точками. Відтак, рецептивні поля колбочок виявились значно більшими, аніж їх діаметри: одинична колбочка проявляла гіперполяризацію у відповідь на освітлення колбочок, що знаходились на відстані ~40 мкм від неї. Також пропусканням струму через одну колбочку, можна було зафіксувати зміну потенціалу на сусідній колбочці.
Подібний феномен впливу рецепторного поєднання на потенціал клітини був відкритий і в паличках, які, однак, мали ширшу за площею просторову сумацію (наприклад, до 200 мкм в кайманової черепахи) та сильніше електричне поєднання. В експерименті, метою якого було виявити реакцію палички жаби на одиничний фотон, на її сітківку були спрямовані розсіяні спалахи світла з такою інтенсивністю, що кожна паличка в середньому повинна була поглинати фотон у ~70 % випадків. Якби палички були ізольовані, то реакція палички на такі стимули повинна була б бути надзвичайно мінливою. Однак реєстрація активності палички з допомогою внутрішньоклітинних мікроелектродів виявила, що реакція одиничної палички на серію спалахів була менш мінливою, аніж передбачається пуассонівським розподілом реакцій на поглинання одиничних фотонів. Коли, до прикладу, інтенсивність стимулювальних спалахів світла була такою, що в середньому 1,4 молекули родопсину на фоторецептор повинні були знебарвитись, то пуассонівський розподіл передбачає, що ~25 % спалахів не знебарвлять жодної молекули родопсину, 35 % знебарвлять 1 молекулу, 24 % — дві, 16 % — три чи більше. Однак реєстрована гіперполяризація палички потрапляла у вузький діапазон від 440 до 660 мкВ, викликаючи реакцію палички навіть тоді коли вона не поглинала жодного кванту світла та в її зовнішньому сегменті не було знебарвлено жодної молекули родопсину. Ці результати однозначно свідчили, що паличка отримує сигнали від сусідніх клітин і тому впливи від одного фотона усереднюються в понад 100 паличок. Крім того, щонайменше 85 % реакції, реєстрованої в одиничній паличці жаби, спричинено реакціями на знебарвлення молекул родопсину в 8-9 тисячах сусідніх паличок з площею поширення до 0,5 мм2.
Крім міжрецепторних контактів на рівні аксонних терміналей, існують також контакти на рівні внутрішніх сегментів, що були виявлені між фоторецепторами деяких земноводних. Також, окрім електричних міжрецепторних контактів, існують хімічні контакти між прилеглими фоторецепторами. Це можуть бути з'єднання аксонних терміналів двох рецепторів на рівні синаптичної стрічки, або ж проникнення телодендрії з аксонного термінала однієї колбочки в заглиблення аксонних терміналей прилеглих колбочок, де вони формують контакти, як на рівні синаптичної стрічки, так і базального синапса.
З'єднання між колбочками
Зазвичай, великі щілинні з'єднання зустрічаються тільки між рецепторами одного типу, тому з'єднання колбочка-колбочка чи паличка-паличка є більшими, ніж з'єднання колбочка-паличка, що є значно меншими. До прикладу, в сітківці приматів середній розмір конексинових бляшок (сукупність до тисячі каналів одного щілинного контакту) щілинних контактів між червоними/зеленими колбочками складає 0,28 мкм2, між синіми колбочками — 0,21 мкм2, а між колбочкою та паличкою — 0,12 мкм2.
З іншого боку, існують переконливі свідчення електричних з'єднань між спектрально різними фоторецепторами, як червоними та зеленими колбочками в сітківці приматів, що виражається в близькості їх спектральних кривих поглинання. Червоні та зелені, але не сині, колбочки невибірково поєднані (зелені з зеленими, червоні з червоними, червоні з зеленими) через конексинні (Cx36) щілинні контакти, із середньою провідністю ~650 пікосименс (пСм), завдяки чому можлива ефективна передача зорових сигналів. Хоча таке невибіркове з'єднання призводить до злиття сигналів про колір, а відтак і до незначного розмиття спектрального розрізнення між колбочками, це компенсується збільшенням у розрізненні яскравості стимулу. Разом з тим, зелені/червоні колбочки формують значно менше електричних контактів з паличками.
Сині колбочки мають менші ніжки ніж червоні/зелені колбочки, тому їх телодендрії рідко торкаються прилеглих колбочок та не формують з ними електричні контакти. Більшість з'єднань через щілинні контакти сині колбочки формують зі сферулами сусідніх паличок. Тому сині колбочки залишаючись відносно ізольованими в мозаїці колбочок, що виражається у віддаленості їх спектральної кривої поглинання від кривих зелених та синіх колбочок. Через відсутність з'єднань між синіми колбочками та їх розріджену мозаїку, сині колбочки завжди оточені кільцем протилежних колбочок. Однією з причин подібної електричної ізоляції синіх колбочок може бути необхідність унеможливити значне погіршання в дискримінації кольорів.
З'єднання між паличками та колбочками
Щілинні контакти між аксонними терміналями колбочок та паличок дозволяють сигналам із паличок прямо надходити до колбочок, звідки вони передаються до колбочкових біполярних нейронів і згодом до гангліозних клітин. Оскільки паличок в сітківці приматів значно більше ніж колбочок, на одну колбочку можуть впливати одразу кілька паличок. У сітківці миші, в якій переважають палички, а колбочки становлять лише 3 % від всіх фоторецепторів, — коефіцієнт конвергенції паличок до колбочок складає ~32.
На користь існування електричного поєднання між паличками та колбочками отримано низку переконливих свідчень: а) реєстрація генерованих паличками сигналів в колбочках сітківок різних модельних тварин, б) виявлення паличкових сигналів в гангліозних клітинах після блокади первинного паличкового шляху; в) чисельні свідчення психофізичних досліджень про існування кількох окремих паличкових шляхів.
Електричне поєднання паличка-колбочка формує поряд із первинним шляхом (палички-горизонтальні-біполярні нейрони) вторинний шлях для передачі сигналу паличок. Вторинний паличковий шлях виконує важливу роль при проміжних інтенсивностях світла, для підтримки сутінкового зору. Сутінковий зір заповнює розрив між нічним зором (спирається на палички і безколірний) та денним зором (спирається на колбочки, кольоровий). Оскільки в сутінках відбувається насичення синапсів паличок (не реагують на зміни інтенсивності), то електричне з'єднання між паличками та колбочками надає доступ паличкам до синапсів колбочок, щоб кодувати збільшення інтенсивності світла, а також уможливлює інтеграцію сигналів паличок в колбочковий нейронний шлях, оминаючи первинний, паличковий шлях.
Сигнали, які передаються первинним паличковим шляхом є найбільш чутливими до яскравості стимулу, тоді як сигнали, які передаються вторинним паличковим шляхом, на одну логарифмічну одиницю менш чутливі. Тому діапазон дії цих двох паличкових шляхів різний. Хоча первинний паличковий шлях характеризується високою чутливістю, нелінійність передачі сигналу його синаптичними зв'язками призводить до звуженого діапазону дії. Відтак вторинний паличковий шлях дозволяє сигналам паличок, генерованим в умовах сутінок, досягнути гангліозних клітин тоді, коли первинний шлях насичений і не в змозі передати ці сигнали. Інша відмінність між первинним та вторинним паличковим шляхом пов'язана з різними підтипами гангліозних клітин, на які вони спрямовані. Тоді як в сітківці кроликів два паличкові шляхи спрямовані на два різні підтипи гангліозних клітин, в сітківці миші вони сходяться на більшість OFF-гангліозних клітин.
Поєднання паличка-колбочка є надзвичайно пластичним і модулюєтьсяциркадними ритмами, бувши максимальним протягом суб'єктивної ночі та мінімальним протягом суб'єктивного дня. Протягом дня циркадний годинник збільшує вивільнення нейромедіатора дофаміну, який активує на паличках та колбочках дофамінові рецептори D2/D4, що в свою чергу зменшує внутрішньоклітинну активність циклічного аденозинмонофосфату (цАМФ) та цАМФ-залежноїпротеїнкінази, внаслідок чого зменшується електрична провідність щілинних з'єднань між паличками та колбочками. Тоді як зменшення вночі вивільнення дофаміну обумовлює стійку електричну єдність між колбочками та паличками. Подібне модулювання щілинних контактів паличка-колбочка дозволяє вторинному паличковому шляху функціонувати при нічних умовах освітлення, підсилюючи виявлення тьмяних об'єктів: палички відсилають інформацію про тьмяне освітлення колбочкам, які її вже відсилають своїм постсинаптичним нейронам. З іншого боку, зменшення провідності між паличками та колбочками вдень не допускає надходження сигналів колбочок до не функціонуючої (насиченої) за цих умов мережі паличок, що б призвело до послаблення і втрати цих сигналів.
Відтак, електричне поєднання між паличками та колбочками у ссавців функціює, як синаптичний механізм, через який циркадним годинником регулюється надходження сигналів від паличок до колбочок та до колбочкових нейронів нижчого порядку.
З'єднання між паличками
В сітківці ссавців був виявлений також третій паличковий шлях. В експерименті з генетично зміненими мишами, сітківки яких не мали колбочок, у їх OFF-гангліозних клітинах були виявлені характерні для паличок сигнали, навіть тоді, коли первинний паличковий шлях блокувався агоністом метаботропних глутаматних рецепторів — L-(+)-2-аміно-4-фосфономасляною кислотою (L-AP4) . Висувалось припущення, що за відсутності у таких мишей щілинних з'єднань між паличками та колбочками, інший шлях передачі паличкового сигналу до гангліозних клітин — через прямий хімічний синапс між паличками та OFF-біполярними нейронами. Хоча довгий час вважалось що у ссавців такі синаптичні контакти відсутні, їх існування згодом було підтверджене в сітківці мишей і щурів, котів та кроликів.
Однак, як було виявлено у сітківці миші, тільки одна з п'яти паличок формує хімічний синапс із OFF-біполярним нейроном, що могло свідчити про незначну роль третього паличкового шляху у передачі сутінкових сигналів. Втім, оскільки між аксонними терміналами паличок ссавців також існують щілинні з'єднання, електричні поєднання між паличками можуть збирати сутінкові сигнали на рівні фоторецепторів і відправляти їх до гангліозних клітин через третій паличковий шлях. Тому третій паличковий шлях може використовуватись в сутінках та на світанку, коли доступно більше світла ніж при зоряному світлі і сигнал зібраний через між паличкові щілинні з'єднання може ефективно кодувати слабко освітлені об'єкти.
Існують також фізіологічні свідчення, що прямі хімічні синапси між паличками та OFF-біполярними нейронами дійсно формують третій паличковий шлях у сітківці ссавців. Зокрема, паличкові сигнали були реєстровані в гангліозних клітинах після блокування первинного та вторинного паличкового шляхів і ці клітини не отримували вхідні сигнали від двох інших шляхів. Такі паличкові сигнали мають нижчу чутливість до сутінків, аніж сигнали, які передаються двома іншими шляхами, що свідчить про залучення третього паличкового шляху до зору в сутінках та на світанку. Навіть у сітківці нокаут них мишей, в яких були вимкнені гени, що кодують конексин (Cx36) та відсутні щілинні з'єднання між паличками та колбочками, зберігались паличкові сигнали, які передаються третім паличковим шляхом. Це свідчило про неушкодженість електричного поєднання між паличками і, отже, вказувало на те, що у щілинних з'єднаннях між паличками відсутній конексин Cx36.
Функції міжрецепторних з'єднань
З теоретичної точки зору існування міжрецепторних з'єднань, зокрема між колбочками, повинно приводити до втрати гостроти та розмивання зображення на сітківці. На основі обчислень та психофізичних експериментів було встановлено, що електричні поєднання між колбочками у центральній ямці сітківки людини призводять до розмиття зорових сигналів та зменшення гостроти зору.
Ще в перших дослідженнях міжрецепторного поєднання, в оригінальному експерименті з сітківкою черепахи, було виявлено стійку кореляцію між внутрішньоклітинним шумом (коливанням напруги) та силою з'єднань між фоторецепторами (вимірюваною через просторову сталу, λ) і зроблено висновок, що електричні з'єднання покращують співвідношення сигнал/шум (S/N) як в паличках, так і колбочках. В колбочках черепах при стимуляції розсіяним освітленням сигнал є незалежним від сталої довжини (λ), але середнє квадратичне амплітуди шуму є обернено пропорційним λ (колбочкам із довшими λ притаманний значно вищий шум, аніж колбочкам з короткими λ), тому S/N прямо збільшується зі збільшенням λ. Це відношення не діє у випадку освітлення малою точкою, яка активує лише одну колбочку, оскільки із збільшенням λ сигнал спадає швидше, ніж квадратний корінь шуму.
Тож додавання сигналів сусідніх колбочок завдяки міжрецепторному поєднанню призводить до усунення шуму, породженого фотонами та іонними каналами, завдяки чому є можливе розрізнення найменших відмінностей в сигналі колбочки і покращення роздільної здатності зору. Хоча подібне усереднення сигналів через електричні з'єднання є теоретично можливим і на рівні біполярних нейронів, які на периферії сітківки формують контакти з багатьма фоторецепторами, однак з'єднання саме на рівні фоторецепторів значно більше покращують S/N. Тому функцією фоторецепторних щілинних контактів є зменшення шуму в синапсові між рецепторами та нижчестоячими нейронами, що повинно призводити до значного покращення передачі фоторецепторного сигналу сітківкою. Усереднення рецепторних сигналів повинно також зменшувати кількість синаптичних з'єднань, необхідних між фоторецепторами та нижчестоячими нейронами, яким відтак не потрібно контактувати з кожним рецептором.
Подальші численні дослідження міжрецепторних з'єднань переконливо показали, що електричне поєднання колбочок зменшує шум і підсилює сигнали, корельовані між сусідніми фоторецепторами. Оскільки процесу внутрішньоклітинної фототрансдукції притаманний шум (внаслідок квантової природи світла, спонтанного знебарвлення зорового пігменту та коливання провідності іонних каналів), то внутрішній шум в кожній колбочці є незалежним від шуму сусідніх колбочок. Тоді як обумовлена зором активність одиничної колбочки корелює із такою ж активністю прилеглих колбочок внаслідок сприйняття спільних стимулів у зображенні та розсіяння світла під час його проходження через рогівку та кришталик ока. Тому електричне поєднання між колбочками призводить до сумації корельованих зорових сигналів та зменшення несинхронного шуму.
Обчислення передбачають, що електричне поєднання між колбочками центральної ямки сітківки ховрахів покращує S/N кожної колбочки на 77 %, призводячи до вищої роздільної здатності зору. Моделювання щілинних контактів між фоторецепторами також показали, що покращення S/N завдяки електричному міжрецепторному поєднанню дозволяє сітківці краще виявляти та локалізувати границі між областями з різною яскравістю. Це пов'язане з тим, що щілинні контакти зменшують не тільки часовий шум, який постає внаслідок спонтанності внутрішньоклітинних процесів та надходження фотонів, але також і некорельований просторовий шум у вихідних сигналах фоторецепторів, який притаманний просторовому розподілу яскравості. Фоторецептори, які моделювались як електрично ізольовані, були не в змозі виявити розширені між областями з різною яскравістю низькоконтрастні границі, тоді як поєднання фоторецепторів через щілинні контакти згладжувало вихідні потенціали, уможливлюючи легке виявлення сітківкою границь, хоча й ціною втрати певних низькоконтрастних деталей із просторового розподілу яскравості, що згладжувались разом з некорельованим шумом.
В цілому, поєднання між колбочками покращує чутливість та вірогідність зорових сигналів, хоча й коштом певного «нейронного розмиття» зображення. Однак на відміну від розмиття зображення, спричиненого оптикою ока, нейронне розмиття є значно меншим. Міжрецепторне поєднання колбочок також усуває шум на рецепторному рівні, перш ніж він потрапить до нижчестоячих нейронів сітківки.
Крім того, електричне поєднання між фоторецепторами виконує інтегративну функцію. Збільшення рецептивного поля внаслідок електричного з'єднання призводить до підсилення реакції колбочок та паличок навіть на невелике збільшення площі стимулу освітлення.
Електричне поєднання між зеленими/червоними колбочками сприяє виявленню змін в яскравості через усереднення шуму в популяції колбочок із корельованими вхідними сигналами. Моделювання колбочок черепахи свідчать, що для стимулів яскравості, рівних чи більших, ніж площа поєднаних колбочок, S/N в колбочках збільшується на 35 %. На відміну від яскравості, кольоровий зір спирається на некорельовані сигнали між колбочками різних спектральних типів. В цьому випадку електричне поєднання між червоними та зеленими колбочками повинно призводити до зменшення S/N для кольорових сигналів. Однак виявлена у примат невибірковість електричного поєднання зелених-червоних колбочок може відображати обчислювальний компроміс, потрібний для кодування обмеженим масивом фоторецепторів як інформації про колір, так і про яскравість стимулів. Тож хоча з'єднання червоних та зелених колбочок і призводить до незначного зменшення здатності до розрізнення кольорів, воно значно підвищує розрізнюваність яскравості.
Крім того, зелені та червоні колбочки формують хоч і регулярну, але окрему мозаїку в сітківці, наслідком чого є висока ймовірність з'єднань між спектрально однаковими колбочками та менша ймовірність з'єднання між спектрально відмінними колбочками. Така окремішність мозаїк червоних та зелених колбочок зменшує спектральне згладжування, спричинене електричним поєднанням.
Іншою важливою функцією міжрецепторного поєднання є перехрестя шляхів передачі паличкових та колбочкових сигналів. Тоді як у фоторецепторів черепахи та земноводних таке перехрестя найбільш помітне в паличках (поява додаткових компонентів в кривих чутливості паличок; зміна кінетики реакції паличок; підсилення здатності реагувати на високочастотні стимули), то в сітківці ссавців, які мають відмінну архітектуру фоторецепторів та їх поєднань, вплив поєднання паличка-колбочка найбільш помітний в колбочках (поява високої чутливості у колбочок та повільної інактивації реакції на світло, що притаманне паличкам).
Палички і колбочки: відмінність та подібність
Палички і колбочки мають схожі механізми фототрансдукції та гіперполяризації, але різні молекулярні складові, швидкості внутрішньоклітинних процесів та синаптичні зв'язки із постсинаптичними нейронами сітківки, що призводить до відмінних реакцій паличок і колбочок на різні діапазони інтенсивностей світла. Ці відмінності між двома класами фоторецепторів обумовлені тим, що палички, аби забезпечувати надійний зір при тьмяному світлі, повинні бути максимально чутливими до світла, тоді як колбочки повинні забезпечувати високу гостроту зору і його адаптованість до широкого діапазону інтенсивностей денного світла.
Абсолютний поріг зору
Поріг відчуття — це найменший рівень світлової енергії, необхідний щоб зоровий стимул був виявлений спостерігачем, цілком адаптованим до темряви. Відтак, абсолютний поріг визначає найменшу кількість фотонів, що може бути виявлена зоровою системою спостерігача і тому покладає найнижчу межу зорового виявлення стимулу.
Палички є фоторецепторами, які здатні сигналізувати зоровій системі схоплення одиничних фотонів. Абсолютний поріг паличок людини та миші відповідає менше ніж 70 фотонам, які реєструються на рогівці. При таких порогових стимулах на молекули родопсину припадає від 10 до 25 фотонів в ділянці сітківки, що містить тисячі паличок. Відтак, в умовах абсолютного порогу жодна паличка не схоплює більше, аніж 1 фотон. Зоровий поріг визначається винятково паличками в понад 3-4 log10 одиниць фонової інтенсивності світла.
Скотопічний та фотопічний зір
Людина здатна бачити в величезному діапазоні інтенсивностей видимого світла, від фотонних потоків менше ніж 10−2 фотонів/(мкм2·с) (зоряне світло) до більше аніж 108 фотонів/(мкм2·с) (яскраве сонячне світло). Така адаптація людського зору пов'язана із тим, що мозаїка двох класів фоторецепторів сітківки (палички і колбочки) оптимально покриває весь діапазон інтенсивностей світла (1010), який доступний людському оку.
Коли рівень яскравості світла дуже низький (наприклад, при зоряному світлі), то активними зостаються тільки надзвичайно світлочутливі фоторецептори — палички, які, відтак, відповідальні за скотопічний (нічний) зір людини й хребетних. Зі зростанням рівня яскравості освітлення до проміжного рівня, наприклад, при місячному світлі, активуються одночасно колбочки і палички (мезопічний зір). При ще більшому зростанні рівня світла палички насичуються і більше не реагують на зміну інтенсивностей світла, залишаючи активними тільки колбочки, які підтримують фотопічний зір при яскравому, денному освітленні. В цілому, на різних рівнях фоторецепторів існує кілька механізмів, що дозволяють фоторецепторам функціонувати у великому діапазоні освітлення. Такими є механізми підсилення в зовнішньому сегменті, що зменшують біохімічний та електричний відгук на фотон, а також наявність у внутрішньому сегменті та клітинному тілі гіпеполяризаційно-активованих катіонних каналів (HCN1), які відновлюють деполяризацію мембрани фоторецептора при сталому освітленні. Іншим механізмом є зворотний вплив із горизонтальних нейронів на фоторецепторний синапс, завдяки чому регулюється частота вивільнення везикул та Ca2+.
Швидкість насичення
Перехід від скотопічного до фотопічного зору характеризується насиченням (нечутливістю до зміни інтенсивностей світла) паличок. Насичення паличок відбувається при частоті схоплення фотонів більше ніж 5000 R* с-1 (R* — молекули активованого родопсину).
Однією з функціональних властивостей, що найбільше різнить колбочки від паличок є те, що колбочка насичується при значно вищих частотах фотонів, ніж паличка.
Існують три ключові механізми, які дозволяють колбочкам уникати насичення: а) наявність сильніших фототрансдуктивних механізмів відновлення до первинного стану зорового пігменту (трансдуцин і фосфодіестараза колбочки деактивуються в ~20 швидше, ніж в палички); б) колбочки в 60 тис. разів швидше повертають хромофор ретиналь до його зігнутого стану (11-цис-ретиаль), аніж ретиналь ізомеризується світлом (переходить в зігнутий все-транс ретиналь стан); в) здатність адаптуватись до постійного світла з будь-якою інтенсивністю.
Поєднання цих механізмів в колбочках дозволяє їм функціонувати при сталих рівнях світла, що знебарвлює більшу частину їх фотопігменту. При таких рівнях світла, чутливість до найменших змін контрасту є обернено пропорційною фону, незалежно від його інтенсивності, уможливлюючи уникання насичення колбочок для всіх вищих інтесивностей.
Світлочутливість
Функціональні властивості реакції на світло паличок і колбочок сітківки хребетних знаходяться у відповідності з екологічними потребами їх поведінки. Морфологія, структура фотопігментів, механізми фототрансдукції та адаптації дозволяють паличкам і колбочками хребетних покривати весь діапазон видимого світла, забезпечують надійне відтворення та передачу інформації як про надзвичайно яскраве, так про надзвичайно тьмяне світло.
Завдяки унікальній анатомічній структурі та молекулярним складовим паличок, єдиний фотон може викликати більший від внутрішньоклітинного шуму електричний відгук в повністю адаптованій до темряви паличці, коли збуджується тільки одна молекула зорового пігменту. Хоча надійне виявлення тьмяного спалаху світла потребує сигналів від 5 до 10 паличок. Тоді як для генерування подібного відгуку, колбочкам потрібно більше ніж 100 фотонів, оскільки внутрішньоклітинний струм, генерований в колбочках одиничним фотоном є відносно малим і його важко відрізнити від фонового шуму. Тому колбочки генерують відмінний від фонового шуму сигнал тільки коли спалахи світла збуджують 4-10 молекул зорових пігментів / колбочку.
Однією з причин високої світлочутливості паличок у порівнянні з колбочками є те, що перші кроки в каскаді паличкової фототрансдукції характеризуються більшим коефіцієнтом підсилення та швидше призводять до закриття іонних каналів. Завдяки цьому відгук колбочки на поглинений фотон є значно швидшим. Крім того, чутливість палички до світла збільшується через те, що її зовнішній сегмент має більш високу стопку мембранних дисків, ніж колбочки, тому фотон, який надходить знизу цієї стопки матиме більшу ймовірність бути поглинутим перш ніж він потрапить до вершини стопки дисків.
Підсилення світлового сигналу
Оскільки палички містять більше зорових пігментів, ніж колбочки, вони можуть схоплювати більше падних фотонів. Але щоб виявити і надійно передати інформацію про одиничні фотони, палички також значно більше підсилюють світлові сигнали в більший фотострум, аніж колбочки..
Як в паличках, так і колбочках підсилення досягається через активацію однією молекулою багатьох інших молекул. В паличках миші, коли фотон поглинається та ізомеризує (випрямляє) ретиналь всередині опсину, то він активує ~20 молекул трансдуцину (Gt), кожна з яких у свою чергу активує одну молекулу фосфодіестарази (ФДЕ), яка може гідролізувати понад 1 тис. молекул циклічного гуанозинмонофосфату (цГМФ). Для відкриття регульованих циклічним нуклеотидом каналів (ЦНР-каналів) потрібно всього 3 молекули цГМФ (коефіцієнт Гілла, n = 3), тому швидке зменшення в паличці концентрації цГМФ призводить до швидкого закриття ЦНР-каналів, а відтак, швидкої гіперполяризації палички. Достатність лише 3 молекул цГМФ для відкриття ЦРГ-каналу гарантує стрімкий відгук (високий коефіцієнт підсилення) палички на зміну в концентрації цГМФ.
Фотоізомеризація однієї молекули родопсину (R*) в паличці призводить до гідролізу 104 молекул цГМФ, що в результаті генерує фотострум, еквівалентний ~106одновалентним іонам, тобто мільйон-кратному підсиленню сигналу. У паличці примат одна фотоізомеризація (R*) генерує фотострум в ~0,7 пА, що п'ятикратно перевершує неперервний темрявний шум. Відтак, в паличці примат темрявний шум, більший від сигналу внаслідок поглинання фотону, є значно рідшим, збільшуючи S/N.
Однак в паличці миші S/N є меншим, оскільки тут фотострум лише в три рази перевершує темрявний шум. Тому багато сигналів, пов'язаних з поглинанням фотонів, які є меншими від середнього, практично нерозрізнювані від неперервного шуму внаслідок темрявних коливань обумовлених спонтанним гідролізом цГМФ. Відтак, поряд зі збільшенням коефіцієнту підсилення, фототрансдукція також повинна зменшувати шум. Цим обумовлені оптимальні молекулярні співвідношення білків, які беруть участь у фототрансдукції. Так, кожен мкм2 дискової мембрани містить наступне співвідношення ефекторних білків: 25 тис. R : 2,5 тис. Gt:330 ФДЕ. З подібною густиною білків середній час для R* знайти Gt шляхом дифузії дорівнює часу, за який R* зв'язує Gt.
В зовнішньому сегменті палички розташовано ~106 цГМФ-регульованих каналів (ЦНР-канали), з яких лише 104 залишаються відкритими через стійку мікромолярну концентрацію кількох молекул цГМФ. Один ізомерезований родопсин, R*, гідролізує ~5 % всіх цГМФ, відтак, закриваючи лише ~5 % всіх відкритих ЦНР-каналів.
Подібно до паличок, у колбочках один фотон також ефективно запускає каскад фототрансдукції. Однак, якщо в паличках один R* закриває ~5 % відкритих ЦНР-каналів, то в колбочці він закриває лише від 0,1 % до 0,01 % каналів. Це встановлює коефіцієнт підсилення колбочки в ~50 разів нижче, аніж в палички. Тому для ефективності відгуку колбочки і вищого S/N, потрібно більше ніж 103 фотонів/час інтегрування.
Час інтегрування світлового сигналу
Хоча палички мають високу світлочутливість, вони реагують на світло повільніше, оскільки інтегрують реакції на фотони протягом довшого періоду (~100 мс). Така повільна реакція дозволяє паличкам виявити слабке світло, але її недоліком є те, що палички не в змозі побачити мерехтіння світла з частотою, швидшою ніж 10-15 Гц.
Подібно до паличок, зоровий пігмент колбочок також реагує на одиничний фотон запускаючи процес фототрансдукції, але в 5 разів швидше, від палички: ~25 мкс щоб досягнути максимальної активності для колбочки у порівнянні з 125 мкс для палички. Такий швидкий відгук колбочок на світло зменшує їх світлочутливість, однак дозволяє їм інтегрувати реакції на фотони за коротший проміжок часу, бувши спроможними розрізнити мерехтіння світла з частотою 80-90 Гц. (Хоча за нормальних візуальних умов, ця частота значно менша — 16-20 Гц.) Перевагою цього є більша часова роздільна здатність колбочки і, як наслідок, більша ширина смуги пропускання. Оскільки пропускна спроможність каналу зростає лінійно із шириною смуги пропускання і логарифмічно із S/N,, то пропускна спроможність колбочки значно перевершує таку паличок.
На відміну від палички, відгук колбочки на одиничний фотон значно менший, а при яскравому світлі взагалі малий, внаслідок чого колбочка може об'єднувати набагато більше сигналів від активованих зорових пігментів протягом її часу інтегрування і таким чином досягнути більш надійного градуйованого сигналу. До прикладу, схоплення 10 тис. фотонів за час інтегрування протягом 100 мск уможливлює співвідношення сигнал/шум (S/N) ~100, тобто √10.000.
Адаптація до світла і темряви
Унікальна здатність колбочок до адаптування до різних діапазонів денного світла дозволяє їм реагувати на зміни понад 9 логарифмічних одиниць — діапазон освітлення від ясного нічного неба (2×10−3люкс) до прямого сонячного світла (1,3×105 люкс).
На відміну від колбочок, палички адаптуються в невеликому діапазоні інтенсивностей світла. Саме тому при яскравому постійному освітленні темрявний струм в зовнішньому сегменті може бути цілком придушений в паличках (насичення паличок), але не в колбочках, де надзвичайно яскраве постійне світло може придушити циркулівний струм лише на короткий період часу, після чого ЦНР-канали знову відкриваються й він відновлюється до нового сталого рівня. До прикладу, коли 90 % зорових пігментів в колбочках людини знебарвлюється, то амплітуда темрявного струму становить лише половину від амплітуди за відсутності світла.
Здатність адаптуватись до широкого діапазону інтенсивностей світла (відома як «світлова адаптація», англ. light adaptation) убезпечує колбочки від насичення та уможливлює функціонування зору протягом всього сонячного дня, коли палички насичуються та не функціонують. Для відновлення чутливості після надходження яскравого світла паличкам потрібно до 1 год, тоді як колбочки відновлюють свою чутливість за декілька хвилин. Подібна зміна в колбочках, відома як темрявна адаптація (англ. dark adaptation), дозволяє колбочкам зберігати сприйнятливість до світла, уможливлюючи неперервне зорове сприйняття в швидко змінюваному світловому середовищі.
Конвергенція сигналів
Висока чутливість паличкового нейронного шляху в сітківці пов'язана з тим, що, залежно від виду тварин, від 20 до 100 паличок відсилають сигнал до одного паличкового біполярного нейрона. Тому сигнали із паличок об'єднуються в одному біполярному нейроні та підсилюють один одного, в такий спосіб зміцнюючи сигнал викликаний одним фотоном в одиничній паличці та збільшуючи здатність зорової системи виявити тьмяне світло. Тоді як значно менше колбочок сходяться на один колбочковий біполярний нейрон. А колбочки в центральній ямці, що мають малий діаметр і розміщені щільно одна відносно одної, взагалі не сходяться на одному біполярному нейронові. Відтак, кожна колбочокова біполярна клітина отримує сигнал із єдиної колбочки, уможливлюючи виняткову гостроту денного (фотопічного) зору.
Оптичні властивості фоторецепторів
Фоторецептор у сітківці виконує подвійне завдання: спрямовує світло до зорових пігментів і використовує пігмент для перетворення енергії світла в нейронний сигнал. Відтак, фоторецептор виконує як оптичні, так і фотохімічні функції.
Завдяки видовженій, тонкій структурі фоторецепторів, що мають вищий показник заломлення аніж навколишнє середовище, фоторецептори діють, як біологічні оптоволоконні хвилеводи, ефективно скеровуючи світло уздовж всієї їх довжини шляхом повного внутрішнього відбиття і тому можуть бути оптично ізольованими один від іншого, уникаючи розсіяння світла на сусідні клітини і розмиття зображення.
Чутливість фоторецепторів нормального ока є найбільшою щодо до світла, що входить до ока біля центру зіниці і спадає майже симетрично, коли точка входу світла зміщується в напрямку до периферії зіниці. Така зміна відносної світлової ефективності як функція від положення на сітківці називається «ефект Стайлса — Кроуфорда І порядку» (ЕСКІ).
Ключовою причиною ЕСКІ є не властивості оптики ока (рогівки, кришталика чи зіниці), а унікальна оптика фоторецепторів, зокрема хвилевідні властивості колбочок, оскільки їх форма та показник заломлення надають їм чутливість до напрямку світла Вирівнювання колбочок відносно центру зіниці ока пов'язане з тим, що колбочки є фототропіничими та активно орієнтуються до світла, подібно до соняшника в полі.
Див. також
Джерела
| |||||||||||||||||||||||||||||||||||||||||||
| Ця стаття належить до добрих статей української Вікіпедії. |