Хлороводень
| Хлороводень | |
|---|---|
|
модель молекули
|
|
| Назва за IUPAC | гідроген хлорид |
| Інші назви | хлоран |
| Ідентифікатори | |
| Номер CAS | 7647-01-0 |
| Номер EINECS | 231-595-7 |
| KEGG | D02057 |
| ChEBI | 17883 |
| RTECS | MW4025000 |
| SMILES | Cl |
| InChI | InChI=1S/ClH/h1H |
| Номер Бельштейна | 1098214 |
| Номер Гмеліна | 322 |
| Властивості | |
| Молекулярна формула | HCl |
| Молярна маса | 36,5 г/моль |
| Зовнішній вигляд | безбарвний газ |
| Густина | 1,477 г/л |
| Тпл | −114,22 °C |
| Ткип | -85 °C |
| Розчинність (вода) | добра |
| Кислотність (pKa) | –7,0 |
| Небезпеки | |
| Індекс ЄС | 017-002-00-2 |
| Класифікація ЄС |
|
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Хло́рово́день — неорганічна сполука ряду галогеноводнів складу HCl. За звичайних умов є безбарвним задушливим газом із різким запахом, димить на повітрі. Легко розчиняється у воді (500 об'ємів газу у 1 об'ємі води) з утворенням хлоридної кислоти (її іноді помилково називають хлороводнем).
Зміст
Історія
Алхіміки середньовіччя знали про acidum Calic (так вони називали хлоридну кислоту), та газ який з неї утворюється, який називали солоне повітря. В 17 столітті, Йоганн Рудольф Глаубер, використовуючи сіль (хлорид натрію) та сульфатну кислоту для виробництва сульфату натрію виділив хлороводень. Карл Вільгельм Шеєле також згадує цю реакцію в 1772 році, відкриття хлороводню приписується йому. У тому ж році Джозеф Прістлі і Гемфрі Деві виявили, що хлороводень складається з гідрогену і хлору.
Під час промислової революції, попит на лужні речовини, такі як карбонат натрію (Na2CO3), збільшився, в 1791 році Ніколя Леблан розробив новий метод виробництва кальцинованої соди. У цьому методі кухонна сіль перетворюється в карбонат натрію, сульфатну кислоту, вапняк та вуглекислий газ і хлороводень як побічний продукт. До 1863 року, хлороводень викидався в повітря але згодом за допомогою рослинної золи хлороводень розчиняли у воді, отримуючи хлоридну кислоту в промислових масштабах. На початку 20 століття, метод Леблана замінив метод Сольве, в якому хлороводень не виділявся. Тим не менш, виробництво хлороводню продовжувалось, оскільки хлоридна кислота активно використовувалась.
У 20-му столітті хлороводень почали використовувати для виробництва хлоропрену, вінілхлориду і т.д
Фізичні властивості
Хлороводень складається з двоатомних молекул, кожна з яких складається з Гідрогену і Хлору. Молекула пов'язана ковалентним зв'язком. Оскільки атом Хлору набагато більш електронегативний, ніж атом Гідрогену, ковалентний зв'язок між двома атомами сильно полярний. Отже, молекула має великий дипольний момент з негативним частковим зарядом δ− на атомі хлору і позитивним частковим зарядом δ+ на атомі водню. Частково через високу полярність, HCl дуже розчинний у воді (і в інших полярних розчинниках). При контакті, H2O і HCl в сукупності утворюють катіон гідроксонію, Н3O+ та хлорид аніон Cl− через оборотну хімічну реакцію:
Отриманий розчин — хлоридна кислота. Процес розчинення сильно екзотермічний. Константа дисоціації або константа іонізації,Ka, велика, що означає, HCl дисоціює і іонізується практично повністю у воді.
З водою хлороводень утворює азеотропну суміш, що містить 20,24% HCl.
Навіть за відсутності води хлористий водень все ще може виступати як кислота. Наприклад, хлористий водень може розчинятися в деяких інших розчинниках, таких як метанол. Через свій кислий характер хлористий водень відноситься до корозійних матеріалів, особливо в присутності вологи. Цілком сухий HCl не проводить електричного струму.
Структура і властивості
|

|
|
|
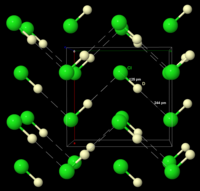
Структура DCl, визначена нейтронною дифракцією DCl в порошкоподібному стані при температурі -196,15 °С. DCl був використаний замість соляної кислоти, оскільки ядро Дейтерію легше виявити, ніж ядро водню. "Нескінченний" ланцюг DCl позначений пунктирними лініями.
| ||
За нормальних умов, хлороводень — це безбарвний газ, який на повітрі димить, взаємодіючи з атмосферною вологою. У рідкому вигляді — безбарвна рухома рідина. Кристалізується в кубічну ґратку, нижче −174,15 °С з утворенням ромбічної модифікації.
Отримання
У лабораторних умовах хлороводень одержують при дії концентрованої сульфатної кислоти на хлорид натрію при сильному нагріванні:
У промисловості його добувають зазвичай спалюванням водню в атмосфері хлору у спеціальних пальниках:
HCl також можна отримати гідролізом ковалентних галогенідів, таких як хлористий фосфорит, тіонілхлорид (SOCl2), і гідролізом хлорангідридів карбонових кислот:
Хлоридну кислоту отримують розчиненням газуватого хлороводню у воді.
Хімічні властивості
При нагріванні хлороводень окиснюється киснем (каталізатор — хлорид міді(II) CuCl2):
При дії сильних окисників або при електролізі хлороводень проявляє відновні властивості:
Для хлороводню також характерні реакції приєднання до кратних зв'язків (електрофільне приєднання):
HCl взаємодіє з тріоксидом сірки, утворюючи хлоросульфонову кислоту HSO3Cl:
Безпека
Вдихання хлороводню може призвести до кашлю, задухи, запалення носа, горла, і верхніх дихальних шляхів, а у важких випадках, набряку легень, порушення роботи кровоносної системи, і навіть смерть. Контактуючи зі шкірою може викликати почервоніння, біль, і важкі опіки. Хлористий водень спричиняє серйозні опіки очей і незворотне пошкодження очей.
Джерела
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
| ||||||||