Молекулярна нейронаука
Молекулярна нейронаука — це розділ нейронауки, який вивчає концепції молекулярної біології, застосовані до нервової системи. Ця галузь зосереджується на молекулярних основах функціонування мозку та діяльності нервової системи. Молекулярна нейронаука охоплює такі теми, як молекулярна нейроанатомія, механізми молекулярної сигналізації в нервовій системі, вплив генетики та епігенетики на розвиток нейронів, а також молекулярні основи нейропластичності та нейродегенеративних захворювань — вивчаючи все це на молекулярному рівні.
Як і молекулярна біологія, молекулярна нейронаука є відносно новою галуззю, яка бурхливо розвивається. Вивчаючи молекулярні структури та взаємодію нейронів і гліальних клітин, дослідники молекулярної нейронауки досліджують таємниці функціонування та дисфункції мозку та розробляють нові методи лікування неврологічних розладів. За останні кілька десятиліть молекулярна нейронаука стала міждисциплінарною галуззю, що швидко розвивається, спираючись на методи біохімії та нейрохімії, генетики й епігенетики, біофізики, нейрофізіології, нейровізуалізації тощо.
Зміст
Історія
Поле молекулярної нейронауки сягає корінням у середину 20-го століття, коли дослідники почали розгадувати хімічні та молекулярні основи нейротрансмісії — передачі сигналів нейронами, переважно завдяки нейромедіаторам. У 1950-х і 1960-х роках дослідження таких учених, як Бернард Кац, Ульф фон Ейлер і Джульєс Аксельрод, привели до відкриття нейромедіаторів і розробки концепції синаптичної передачі.
У 1970-х і 1980-х роках прогрес у методах молекулярної біології дозволив клонувати та охарактеризувати багато рецепторів нейромедіаторів та іонних каналів. Ці відкриття привели до глибшого розуміння молекулярних механізмів передачі нейронних сигналів і забезпечили нові цілі для розробки ліків.
У 1990-х і 2000-х роках галузь молекулярної нейронауки розширилася, щоб охопити вивчення нейронного розвитку та нейропластичності. Дослідники почали ідентифікувати молекулярні шляхи та сигнальні молекули, що беруть участь у диференціації нейронів, синаптогенезі та синаптичній пластичності.
Сьогодні молекулярна нейронаука — це галузь, що швидко розвивається, і охоплює широкий спектр тем, від генетичної основи неврологічних розладів до розробки нових методів лікування захворювань мозку. Дослідники використовують такі передові методи, як оптогенетика, секвенування окремих клітин і візуалізація мозку, щоб отримати нові знання про молекулярну основу функції та дисфункції мозку.
Молекуляні основи нейротрансмісії
Молекулярні основи передачі нейронних сигналів відноситься до складної серії подій, які відбуваються на молекулярному рівні для забезпечення зв’язку між нейронами та іншими клітинами нервової системи. На самому базовому рівні передача нейронних сигналів включає вивільнення нейромедіаторів з одного нейрона, які потім зв’язуються з рецепторами іншого нейрона для передачі сигналу.
Вивільнення нейромедіаторів опосередковується різноманітними молекулярними механізмами, включаючи відкриття напругозалежних кальцієвих каналів у пресинаптичному нейроні та подальше злиття синаптичних везикул із плазматичною мембраною пресинаптичного нейрона. Після вивільнення нейромедіатори зв’язуються зі специфічними рецепторами постсинаптичного нейрона, запускаючи каскад внутрішньоклітинних сигнальних подій, які зрештою призводять до змін у активності нейронів.
Молекулярні компоненти нейронної сигналізації включають іонні канали, рецептори нейромедіаторів, внутрішньоклітинні сигнальні молекули та цитоскелетні білки. Іонні канали відіграють вирішальну роль у генеруванні та передачі електричних сигналів у нейронах, забезпечуючи швидке поширення потенціалів дії вздовж аксонів. Рецептори нейромедіаторів, включаючи ліганд-керовані іонні канали та G-білкові рецептори, опосередковують вплив нейромедіаторів на постсинаптичні нейрони.
Внутрішньоклітинні сигнальні молекули, такі як циклічний АМФ, іони кальцію та протеїнкінази, відіграють ключову роль у модулюванні активності та пластичності нейронів. Білки цитоскелета, такі як актин і мікротрубочки, також важливі для підтримки структури і функції нейронів і регуляції синаптичної пластичності.
Загалом, молекулярна основа передачі нейронних сигналів є складним і динамічним процесом, який включає широкий спектр молекулярних компонентів і сигнальних шляхів. Розуміючи молекулярні механізми, що лежать в основі передачі нейронних сигналів, дослідники сподіваються отримати нові знання про функціонування мозку та нервової системи, а також розробити нові методи лікування неврологічних розладів.
Розташування нейромедіаторів
На молекулярному рівні зв'язок між нейронами, зазвичай, відбувається шляхом хімічної передачі через проміжки між клітинами, які називаються синапсами. Хімічні речовини, що передаються, відомі як нейромедіатори (нейротрансмітери), регулюють значну частину життєво важливих функцій організму.
За допомогою методів маркування можливо визначити місцезнаходження конкретних нейромедіаторів. Також можливо хімічно ідентифікувати певні нейромедіатори, наприклад, катехоламіни, шляхом фіксації зрізів нервової тканини формальдегідом. Це може призвести до флуоресценції, спричиненої формальдегідом, під впливом ультрафіолетового світла. Дофамін був ідентифікований у нематоди C. elegans за допомогою цієї методики.
Імуноцитохімія — ще одна цікава методика, яка передбачає вироблення антитіл проти цільових хімічних або біологічних об'єктів. Досліджуваний нейромедіатор може бути спеціально позначений первинними та вторинними антитілами з радіоактивним маркуванням, щоб ідентифікувати нейромедіатор авторадіографією. Наявність нейромедіаторів (хоча не обов'язково розташування) можна спостерігати за допомогою імуноцитохімії з ферментами або імуноферментних аналізів (ELISA), у яких зв'язування субстрату в ферментативних аналізах може індукувати преципітати, флуорофори або хемілюмінесценцію.
У випадку, якщо нейромедіатори неможливо ідентифікувати гістохімічно, альтернативним методом є визначення їх місцезнаходження за механізмами нейронного поглинання.
Напругозалежні іонні канали
Збудливі клітини в живих організмах мають потенціалзалежні іонні канали. Їх можливо спостерігати по всій нервовій системі в нейронах. Першими охарактеризованими іонними каналами були натрієві та калієві іонні канали А. Л. Ходжкіна та А. Ф. Хакслі в 1950-х роках після вивчення гігантського аксона кальмарів роду Loligo. Їхні дослідження продемонстрували вибіркову проникність клітинних мембран, залежну від фізіологічних умов, і електричні ефекти, які є результатом цієї проникності для створення потенціалів дії.
Іонні натрієві канали
Натрієві канали були першими напругозалежними іонними каналами, виділеними Шосаку Нумою в 1984 році у вугра Electrophorus electricus. Токсин риби-фугу тетродотоксин (ТТХ), блокатор натрієвих каналів, був використаний для виділення білка натрієвого каналу шляхом його зв'язування за допомогою техніки колонкової хроматографії для хімічного розділення. Амінокислотну послідовність білка аналізували за допомогою деградації Едмана, а потім використовували для створення бібліотеки комплементарних ДНК, яку можна було б використовувати для клонування канального білка. Клонування самого каналу дозволило використовувати такі програми, як ідентифікація тих самих каналів в інших тварин. Відомо, що натрієві канали працюють узгоджено з калієвими під час розвитку градуйованих потенціалів і потенціалів дії. Натрієві канали забезпечують приплив іонів Na + до нейрона, що призводить до деполяризації мембранного потенціалу спокою нейрона, що призводить до градуйованого потенціалу або потенціалу дії, залежно від ступеня деполяризації.
Іонні калієві канали
Калієві канали бувають різноманітних форм, присутні в більшості еукаріотичних клітин і, як правило, мають тенденцію стабілізувати клітинну мембрану на рівні потенціалу калієвої рівноваги. Як і у випадку з іонами натрію, градуйовані потенціали та потенціали дії також залежать від калієвих каналів. Тоді як приплив іонів Na + до нейрона викликає деполяризацію клітини, вихід іонів K + з нейрона викликає реполяризацію клітини до потенціалу спокою мембрани. Активація самих калієвих іонних каналів залежна від деполяризації в результаті надходження Na + під час потенціалу дії.
Як і натрієві канали, калієві канали мають власні токсини, які блокують дію білка каналу. Прикладом такого токсину є великий катіон, тетраетиламоній (TEA), але слід зазначити, що токсин не має однакового механізму дії на всі калієві канали, враховуючи різноманітність типів каналів у різних видів. Наявність калієвих каналів було вперше виявлено у мух-мутантів Drosophila melanogaster, які неконтрольовано тремтіли під час анестезії через проблеми в клітинній реполяризації, що призвело до аномальної електрофізіології нейронів і м'язів. Калієві канали вперше були ідентифіковані шляхом маніпулювання молекулярною генетикою (мух) замість очищення білка каналу, оскільки на момент відкриття не було відомих високоафінних лігандів для калієвих каналів (таких як TEA).
Іонні кальцієві канали
Кальцієві канали важливі для певних клітинних сигнальних каскадів, а також для вивільнення нейромедіаторів в синапси з кінців аксонів. Різні типи іонних кальцієвих каналів знайдено в збудливих клітинах. Як і канали іонів натрію, канали іонів кальцію були виділені та клоновані методами хроматографічного очищення. Примітно, як і у випадку вивільнення нейромедіаторів, що кальцієві канали можуть взаємодіяти з внутрішньоклітинними білками та відіграють значну роль у передачі сигналів, особливо в таких місцях, як саркоплазматичний ретикулум м'язових клітин.
Див. також — Вторинні посередники.
Рецептори
Різні типи рецепторів можуть бути використані для передачі сигналів клітини і зв'язку, та можуть включати іонотропні рецептори та метаботропні рецептори. Ці типи рецепторів клітинної поверхні відрізняються за механізмом і тривалістю дії, причому іонотропні рецептори пов'язані зі швидкою передачею сигналу, а метаботропні рецептори пов'язані з повільною передачею сигналу. Метаботропні рецептори охоплюють широкий спектр рецепторів клітинної поверхні з помітно різними сигнальними каскадами.
Іонотропні рецептори
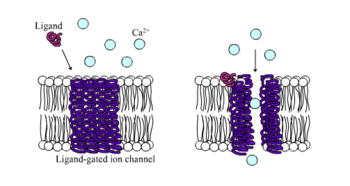
Іонотропні рецептори, також відомі як ліганд-залежні іонні канали, є швидкодіючими рецепторами, які опосередковують нейронні та фізіологічні функції за допомогою потоку іонних каналів із зв'язуванням ліганду. Нікотинові, ГАМК і глутаматні рецептори є одними з рецепторів клітинної поверхні, які регулюються потоком ліганд-залежних іонних каналів. ГАМК є основним гальмівним нейромедіатором мозку, а глутамат є основним збуджуючим нейромедіатором мозку.
ГАМК-рецептори
Відомо, що рецептори ГАМК А і ГАМК С є іонотропними, тоді як рецептор ГАМК В є метаботропним. Рецептори ГАМК А опосередковують швидкі гальмівні реакції в центральній нервовій системі (ЦНС) і знаходяться на нейронах, гліальних клітинах і клітинах мозкової речовини надниркових залоз. Він відповідає за індукцію припливу іонів Cl - до клітин, тим самим зменшуючи ймовірність того, що деполяризація мембрани відбудеться після надходження градуйованого потенціалу або потенціалу дії. Рецептори ГАМК також можуть взаємодіяти з неендогенними лігандами, впливаючи на активність. Наприклад, сполука діазепам є алостеричним агоністом, який підвищує спорідненість рецептора до ГАМК. Посилені фізіологічні гальмівні ефекти в результаті збільшення зв'язування ГАМК роблять діазепам корисним транквілізатором або протисудомним засобом (протиепілептичним засобам). З іншого боку, ГАМК-рецептори також можуть бути спрямовані шляхом зменшення притоку Cl - клітин за допомогою ефекту конвульсантів, таких як пікротоксин. Антагоністичний механізм дії цієї сполуки не стосується безпосередньо рецептора ГАМК, але існують інші сполуки, які здатні до алостеричної інактивації, включаючи Т-бутилбіциклофоротіонат (TBPS) і пентилентетразол (PZT). Порівняно з ГАМК А рецептори ГАМК С мають вищу спорідненість до ГАМК, вони, імовірно, будуть тривалішими в активності, і їх відповіді, ймовірно, будуть спричинені нижчими концентраціями ГАМК.
Глутаматні рецептори
Іонотропні глутаматні рецептори можуть включати NMDA, AMPA та каїнатні рецептори. Ці рецептори названі на честь агоністів, які сприяють активності глутамату. NMDA-рецептори відомі своїми збудливими механізмами, що впливають на пластичність нейронів у навчанні та пам'яті, а також на невропатології, такі як епілепсія. Рецептори NDMA мають кілька сайтів зв'язування, як іонотропні рецептори ГАМК, і на них можуть впливати коагоністи, такі як нейромедіатор гліцин або фенциклідин (PCP). Рецептори NMDA проводять струм за допомогою іонів Ca 2+ і можуть блокуватися позаклітинними іонами Mg 2+ залежно від напруги та мембранного потенціалу. Цей приплив Ca 2+ посилюється збуджуючими постсинаптичними потенціалами (EPSP), створюваними рецепторами NMDA, активуючи каскади сигналів на основі Ca 2+ (наприклад, вивільнення нейромедіатора). AMPA генерує коротші та більші збуджуючі постсинаптичні струми, ніж інші іонотропні рецептори глутамату.
Нікотинові АХ рецептори
Нікотинові рецептори зв'язують нейромедіатор ацетилхоліну (ACh), створюючи неселективний потік катіонних каналів, який генерує збудливі постсинаптичні реакції. Активність рецепторів, на яку може впливати споживання нікотину, викликає відчуття розслаблення та неминуче звикання у високих рівнях.
Метаботропні рецептори
Метаботропні рецептори є рецепторами повільної реакції в постсинаптичних клітинах. Як правило, ці повільні реакції характеризуються більш складними внутрішньоклітинними змінами в біохімії. Реакція поглинання нейромедіатора метаботропними рецепторами може призвести до активації внутрішньоклітинних ферментів і каскадів за участю вторинних месенджерів, як у випадку з рецепторами, пов'язаними з білком G. Різні метаботропні рецептори можуть включати певні глутаматні рецептори, мускаринові рецептори ACh, рецептори GABA B і рецептори тирозинкіназ.
G-білок-спряжені рецептори
Сигнальний каскад, пов'язаний з G-білком, може значно підсилювати сигнал певного нейромедіатора, щоб виробляти від сотень до тисяч вторинних посередників (месенджерів) у клітині. Механізм дії, за допомогою якого G-білок-спряжені рецептори, викликають сигнальний каскад, полягає в наступному:
- Нейромедіатор зв'язується з рецептором
- Рецептор зазнає конформаційних змін, щоб забезпечити зв'язування G-білкового комплексу
- Гуанозиндифосфат (ГДФ) обмінюється з гуанозинтрифосфатом (ГТФ) після зв'язування білкового комплексу G з рецептором
- α-субодиниця білкового комплексу G зв'язується з ГТФ і відокремлюється для зв'язування з цільовим білком, таким як аденілатциклаза
- Зв'язування з білком-мішенню або збільшує, або зменшує швидкість виробництва другого месенджера (наприклад, циклічного АМФ).
- ГТФаза гідролізує α-субодиницю таким чином, що зв'язується з ГДФ, а α-субодиниця повертається до G-білкового комплексу в неактивному стані.
Вивільнення нейромедіатора
Нейромедіатори вивільняються окремими порціями у формі мікро-пухирців, від закінчення аксона одного нейрона до дендритів іншого через синапс. Ці пухирці були ідентифіковані за допомогою електронної мікроскопії і названі синаптичними везикулами. Є два типи везикул — малі синаптичні везикули (SSV), які мають діаметр приблизно 40-60 нм, і великі везикули зі щільним ядром (LDCV), електронно-щільні везикули діаметром приблизно 120—200 нм. Перший утворюється з ендосом і містить такі нейромедіатори, як ацетилхолін, глутамат, ГАМК і гліцин. Останній походить від апарату Гольджі та містить більші нейромедіатори, такі як катехоламіни та інші пептидні нейромедіатори. Нейромедіатори вивільняються з закінчення аксона та зв'язуються з постсинаптичними дендритами наступним чином:
- Мобілізація/залучення синаптичної везикули з цитоскелету аксона нейрона
- Зв'язування (докінг) везикули з пресинаптичною мембраною
- Праймування везикул АТФ (відносно повільний крок)
- Злиття праймованої везикули з пресинаптичною мембраною та екзоцитоз розміщеного нейромедіатора
- Захоплення нейромедіаторів рецепторами постсинаптичної клітини
- Ініціація або гальмування потенціалу дії в постсинаптичній клітині залежно від того, чи є нейромедіатори збудливими чи гальмівними
Кальцій-залежне вивільнення нейромедіаторів
Вивільнення нейромедіаторів залежить від зовнішнього надходження іонів Ca2+, які потрапляють в кінці аксона через напругозалежні кальцієві канали. Везикулярне злиття з кінцевою мембраною та вивільнення нейромедіатора викликано генерацією градієнтів Ca2+, викликаних вхідними потенціалами дії. Іони Ca2+ спричиняють мобілізацію новосинтезованих везикул із резервного пулу для злиття з мембраною. Цей механізм дії був виявлений у гігантських аксонах кальмарів. Зниження внутрішньоклітинних іонів Ca2+ забезпечує прямий інгібуючий ефект на вивільнення нейромедіаторів. Після того, як відбувається вивільнення нейромедіатора, везикулярні мембрани повертаються на місце їхнього виробництва. Кальцієві іонні канали можуть відрізнятися залежно від локалізації. Наприклад, канали в терміналі аксона відрізняються від типових кальцієвих каналів тіла клітини. Навіть на кінцях аксонів типи каналів іонів кальцію можуть змінюватися, як у випадку з кальцієвими каналами типу Р, розташованими в нервово-м'язовому з'єднанні.
Експресія генів в нейронах
Експресія генів — це процес, за допомогою якого генетична інформація використовується для синтезу білків та інших функціональних молекул у клітинах. У нейронах експресія генів є високорегульованим і динамічним процесом, який має вирішальне значення для розвитку, функціонування та пластичності нейронів.
Нейрони мають унікальний профіль експресії генів, який відображає їхні спеціалізовані функції та зв’язок у нейронних ланцюгах. Вони експресують широкий спектр генів, залучених до синтезу нейромедіаторів, експресії іонних каналів і синаптичної функції, а також генів, залучених до регуляції росту та виживання нейронів.
Одним з важливих аспектів експресії генів у нейронах є її динамічна регуляція у відповідь на сигнали навколишнього середовища та активність. Наприклад, активність нейронів може викликати зміни в експресії генів через активацію факторів транскрипції та інших сигнальних молекул. Ці зміни в експресії генів можуть призвести до змін нейронного зв’язку та пластичності, а також до змін у поведінці та пізнанні (див. Нейропластичність).
Іншим важливим аспектом експресії генів у нейронах є її регуляція на рівні структури хроматину та епігенетичних модифікацій. Структура хроматину відноситься до упаковки ДНК у нуклеосоми та структури вищого порядку, які можуть впливати на експресію генів шляхом модуляції доступу до послідовності ДНК. Епігенетичні модифікації, такі як метилювання ДНК і ацетилювання гістонів, також можуть модулювати експресію генів, змінюючи доступність послідовності ДНК для факторів транскрипції та інших регуляторних молекул.
Загалом, експресія генів у нейронах є складним і динамічним процесом, необхідним для належного функціонування нервової системи. Розуміючи молекулярні механізми, що лежать в основі експресії генів у нейронах, дослідники можуть отримати нове уявлення про розвиток, функціонування та пластичність нейронних ланцюгів, а також визначити нові мішені для лікування неврологічних розладів.
Епігенетика головного мозку
На багато функцій мозку можна впливати на клітинному та молекулярному рівнях шляхом варіацій і змін у експресії генів, не змінюючи послідовності ДНК в організмі. Це інакше відомо як епігенетична регуляція. Приклади епігенетичних механізмів включають модифікації гістонів і метилювання ДНК. Було встановлено, що такі зміни сильно впливають на захворювання мозку, психічні захворювання та залежність. Було показано, що епігенетичний контроль бере участь у високих рівнях пластичності на ранніх етапах розвитку, що визначає його важливість у критичний період організму. Приклади того, як епігенетичні зміни можуть впливати на людський мозок:
- Більш високі рівні метилювання в генах рРНК в гіпокампі головного мозку призводять до зниження виробництва білків і, таким чином, обмежена функція гіпокампа може призвести до погіршення навчання та пам'яті.
- У дослідженні, яке порівнювало генетичні відмінності між здоровими людьми та психіатричними пацієнтами, було виявлено 60 різних епігенетичних маркерів, пов'язаних із сигналізацією клітин мозку.
- Фактори навколишнього середовища, такі як жорстоке поводження з дітьми, ймовірно, викликають експресію епігенетичної мітки на глюкокортикоїдних рецепторах (пов'язаних із реакціями на стрес). Це приклад пластичності, що залежить від досвіду.
- Збагачення навколишнього середовища в окремих людей пов'язане зі збільшенням ацетилювання гена гістону гіпокампу і, таким чином, покращенням консолідації пам'яті (зокрема, просторової пам'яті).
Молекулярні механізми нейродегенеративних захворювань
Ексайтотоксичність і глутаматні рецептори
Ексайтотоксичність — це явище, при якому глутаматні рецептори активуються неналежним надмірним чином. Це може бути викликано тривалою збуджувальною синаптичною передачею, при якій високі рівні нейромедіатора глутамату викликають надмірну активацію постсинаптичного нейрона, що може призвести до смерті постсинаптичного нейрона. Було виявлено, що після травми головного мозку (наприклад, ішемії) ексайтотоксичність є значною причиною пошкодження нейронів. Це пояснюється тим, що коли раптова перфузія крові після зниження кровотоку до мозку може призвести до надмірної синаптичної активності, спричиненої наявністю підвищеного вмісту глутамату та аспартату в період ішемії.
Хвороба Альцгеймера
Хвороба Альцгеймера є найпоширенішим нейродегенеративним захворюванням і є найпоширенішою формою деменції у літніх людей. Розлад характеризується прогресуючою втратою пам'яті та різних когнітивних функцій. Існує гіпотеза, що відкладення амілоїд-β пептиду у мозку є невід'ємною частиною захворюваності на хворобу Альцгеймера. Вважається, що накопичення блокує довгострокове потенціювання гіпокампу. Також можливо, що рецептор для олігомерів амілоїду-β може бути пріонним білком.
Хвороба Паркінсона
Хвороба Паркінсона є другим за поширеністю нейродегенеративним захворюванням після хвороби Альцгеймера. Це гіпокінетична (обмежена рухливість тіла) хвороба базальних гангліїв, спричинена втратою дофамінергічних нейронів у чорній субстанції мозку людини. Таким чином, гальмівний відтік базальних гангліїв не зменшується, і тому верхні моторні нейрони, опосередковані таламусом, не активуються своєчасно. Специфічні симптоми включають ригідність, проблеми з поставою, повільні рухи та тремор. Блокування ГАМК-рецепторів від середніх колючих (spiny) нейронів до сітчастих клітин викликає пригнічення верхніх рухових нейронів, подібне до гальмування, яке відбувається при хворобі Паркінсона.
Хвороба Гентінгтона
Хвороба Гентінгтона — це гіперкінетична (надмірна рухливість тіла) хвороба базальних гангліїв, спричинена відсутністю нормальних гальмівних надходжень від середніх шипуватих нейронів базальних гангліїв. Це створює протилежні наслідки тим, що пов'язані з хворобою Паркінсона, включаючи невідповідну активацію верхніх рухових нейронів. Агоніст ГАМК, введений у сітчасту чорну речовину, зменшує гальмування верхніх мотонейронів, що призводить до балістичних мимовільних рухових рухів, подібних до симптомів хвороби Хантінгтона.
Література
Журнали
- Molecular and Cellular Neurosciences
- Molecular Neurobiology
- Cellular and Molecular Neurobiology
- Molecular Neurodegeneration
- Journal of Molecular Neuroscience
- NeuroMolecular Medicine
- Frontiers in Molecular Neuroscience
Книги
- Kandel, E. R., Schwartz, J. H., & Jessell, T. M. (2000). Principles of neural science (4th ed.). McGraw-Hill, Health Professions Division.
- John H. Byrne, Ruth Heidelberger and M. Neal. (2014). From Molecules to Networks An Introduction to Cellular and Molecular Neuroscience. Academic Press. ISBN 978-0-12-397179-1
- Gordon M. Shepherd. (2003). The synaptic organization of the brain. Oxford ; New York :Oxford University Press. ISBN 978-0195159561
- Alberts B. Johnson A. Lewis J. Morgan D. Raff M. C. Roberts K. Walter P. Wilson J. H. & Hunt T. (2015). Molecular biology of the cell (6th ed). Garland Science Taylor and Francis Group.