Холестерол
| Холестерол | |
|---|---|

| |

| |
| Систематична назва | (3β)-холест-5-ен-3-ол |
| Інші назви | Холестерин |
| Ідентифікатори | |
| Номер CAS | 57-88-5 |
| PubChem | 5997 |
| Номер EINECS | 200-353-2 |
| DrugBank | 04540 |
| KEGG | D00040 |
| Назва MeSH | Cholesterol |
| ChEBI | 16113 |
| RTECS | FZ8400000 |
| SMILES | C[C@H](CCCC(C)C)[C@H]1CC[C@@H]2[C@@]1(CC[C@H]3[C@H]2CC=C4[C@@]3(CC[C@@H](C4)O)C)C |
| InChI | InChI=1S/C27H46O/c1-18(2)7-6-8-19(3)23-11-12-24-22-10-9-20-17-21(28)13-15-26(20,4)25(22)14-16-27(23,24)5/h9,18-19,21-25,28H,6-8,10-17H2,1-5H3/t19-,21+,22+,23-,24+,25+,26+,27-/m1/s1 |
| Номер Бельштейна | 2060565 |
| Номер Гмеліна | 550297 |
| Властивості | |
| Молекулярна формула | C27H46O |
| Молярна маса | 386,65 г/моль |
| Зовнішній вигляд | білий кристалічний порошок |
| Густина | 1,052 г/см3 |
| Тпл | 148–150° C |
| Ткип | 360° C |
| Розчинність (вода) | 0,095 мг/л (30° C) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
| Типи жирів у їжі |
|---|
| Дивіться також |
Холестеро́л (іноді холестерин; англ. cholesterol) — речовина з групи стеролів. У значних кількостях міститься в нервовій та жировій тканинах, печінці тощо. У хребетних тварин і людини — біохімічний попередник стероїдних гормонів, жовчних кислот, ліпопротеїнів (сполук, у формі яких ліпіди транспортуються по організму) та вітаміну D. Надлишок холестеролу в організмі людини призводить до утворення жовчних каменів, відкладення холестеролу на стінках судин, порушення обміну речовин.
Зміст
Історія
1769 року Франсуа Пулетьє де ла Саль отримав з жовчних каменів густу білу речовину («жировіск»), що мала властивості жирів. У чистому вигляді холестерол уперше виділив хімік Антуан-Франсуа де Фуркруа в 1789 році. Хімік Мішель-Ежен Шеврель, що теж отримав цю сполуку 1815 року, назвав її холестерином. У 1859 році Марселен Бертло встановив, що холестерин належить до класу спиртів, тому відповідно до номенклатури його назва має утворюватися з суфіксом -ол. У французькій хімічній термінології відразу ж було прийняте нове найменування холестерол, але стара некоректна з наукової точки зору назва збереглась у деяких мовах.
Фізіологія
Холестерол необідний усім тваринам і кожна клітина може синтезувати його через складний процес із 37 кроків. Цей процес починається зі шляху мевалонату або HMGCR (3-гідрокси-3-метилглютарил-кофермент А редуктази), мішені статинів. Цей шлях охоплює перші 18 кроків. Далі слідують 19 кроків із перетворення отриманого ланостерину на холестерол.
Чоловік вагою 68 кг (150 lb) зазвичай синтезує приблизно 1 грам холестеролу на день, а в його тілі знаходиться всього 35 грам, які здебільшого є частиною клітинної мембрани. Щоденно типовий чоловік-американець отримує 307 мг холестеролу з їжі.
Більшість спожитого холестеролу естерифікована, через що він погано всмоктується кишківником. Організм також компенсує недостатнє поглинання спожитого холестерину шляхом зниження синтезу власного. Через це холестерол із їжі після 7-10 годин після споживання має незначний, якщо взагалі має, ефект на концентрацію холестеролу в крові. Однак, протягом перших 7 годин після споживання холестеролу, оскільки абсорбовані жири розносяться по тілу по міжклітинній рідині різними ліпопротеїнами (вони транспортують усі жири по рідині поза клітинами), концентрація зростає.
Рослини виробляють дуже мало холестеролу. У більших кількостях вони виробляють фітостерини, хімічно подібні речовини, які можуть конкурувати з холестерином за реабсорбцію в кишковому тракті, таким чином потенційно знижуючи його реабсорбцію. Коли клітини слизової оболонки кишечника поглинають фітостерини замість холестеролу, вони зазвичай виділяють молекули фітостерину назад у шлунково-кишківниковий тракт, що є важливим захисним механізмом. Споживання фітостеринів природного походження, які складаються з рослинних стеролів і станолів, варіюється між ≈200–300 мг/доба, задежно від харчових звичок. Деякі спеціально розроблені вегетаріанські експериментальні дієти дають більше 700 мг/день.
Функція в клітинах
Мембрани
Холестерол становить 30 % усіх тваринних клітинних мембран. Це необхідно для утворення та підтримки мембран і це регулює текучість мембрани у діапазоні низьких температур. Гідроксильна група кожної молекули холестеролу взаємодіє з молекулами води, що оточує мембрану, як і полярні головки мембранних фосфоліпідів і сфінголіпідів, коли великий стероїдний і вуглеводневий ланцюг вбудовується в мембрану разом із неполярним ланцюгом жирних кислот із інших ліпідів. Через взаємодію з фосфоліпідними ланцюгами жирних кислот холестерол збільшує щільність мембрани, що змінює текучість мембрани і підтримує її цілісність, через що тваринним клітинам не потрібно утворювати клітинну оболонку (як більшості рослин і бактерій). Мембрана залишається міцною та крепкою, але не жорсткою, що дозволяє клітинам тварин змінювати форму, а тваринам рухатися.
Структура тетрациклічного кільця холестеролу сприяє текучості клітинної мембрани, оскільки молекула знаходиться у транс-конформації, роблячи усю молекулу холестеролу окрім бічних ланцюгів жорстким і пласким. Виконуючи цю структурну роль, холестерин також знижує проникність плазматичної мембрани для нейтральних розчинених речовин, йонів водню та йонів натрію.
Презентація субстрата
Холестерол регулює біологічний процес презентації субстрата і ферменти, які використовують механізм презентації субстрата для своєї активації. (PLD2) — чітко визначений приклад такого ферменту. Фермент пальмітується, що спричиняє його рух до холестерол-залежних ліпідних доменів, які іноді називають «ліпідними рафтами». Субстратом фосполіпази D є фосфатидилхолін (PC; ФХ), який є неначименим і містяться в ліпідних рафтах у низькій кількості. ФХ локалізується у хворій частині клітини разом із поліненасиченим жирамом — фосфатидилінозитол-4,5-бісфосфатом (PIP2). PLD2 містить зв'язуючий домен до PIP2. Коли концентрація PIP2 у мембрані зростає, PLD2 залишає холестерол-залежний домен і прив'язується до PIP2, завдяки чому отримує доступ до його субстрата ФХ і розпочинає каталіз на основі презентації субстрата.

Сигналювання
Холестерол також залучений до сигнальних процесів клітин, допомагаючи формувати ліпідні рафти у плазматичній мембрані, що ставить білки-рецептори в безпосередню близькість до високих концентрацій інших клітин-месенджерів. У багатьох шарах холестерин і фосфоліпіди, які обидва є електроізоляторами, можуть сприяти швидкості передачі електричних імпульсів по нервових тканинах. Для багатьох нейронних волокон мієлінова оболонка, багата холестерином, оскільки вона походить від ущільнених шарів мембран шваннівських клітин, забезпечує ізоляцію для більш ефективного проведення імпульсів. Демієлінізація (втрата деяких таких шваннівських клітин) вважається частиною основи розсіяного склерозу.
Холестерол зв'язується з великою кількістю іонних каналів, таких як нікотиновий ацетилхоліновий рецептор, ГАМКA-рецептор і калієві канали внутрішнього випрямлення, та впливає на їх воротний механізм. Холестерол також активує eSRRA (ERRα) і може бути ендогенним лігандом для цього рецептора. Конститутивно активна природа рецептора може бути пояснена тим фактом, що холестерин є всюди в організмі. Інгібування передачі сигналів ERRα шляхом зменшення вироблення холестерину було визначено як ключовий медіатор впливу статинів і бісфосфонатів на кістки, м'язи і макрофагиs. Опираючись на ці дослідження, було запропоновано деорфанувати рецептор ERRα і класифікувати його як рецептор холестеролу.
Прекурсор
Холестерол є також прекурсором для декількох біохімічних шляхів. Наприклад, він є прекурсором для синтезу вітаміну D в метаболізмі кальцію та всіх стероїдних гормонів, включаючи гормони надниркової залози: кортизол і альдостерон, а також гормони прогестерон, естрогени, тестостерон і похідні від них.
Метаболізм
Організм використовує холестерол повторно. Печінка виділяє холестерол у жовч, яка потім зберігається в жовчному міхурі, який потім виділяє їх у неестерифікованій формі (через жовч) у травний. тракт. Як правило, близько 50 % виділеного холестеролу реабсорбується тонкою кишною назад у кров'яний потік.
Біосинтез та регуляція
Біосинтез
Усі тваринні клітини (винятки існують лише у безхребетних) виробляти холестерол для підтримки структури мембран та інших цілей. Відносна величина його вироблення варіюється залежно від типу клітини та функції органу. Близько 80 % від усього виробленого за день холестеролу продукується у печінці та кишках; значні частини решти біосинтезу відбуваються в головному мозку, надниркових залозах та репродуктивних орагнах.
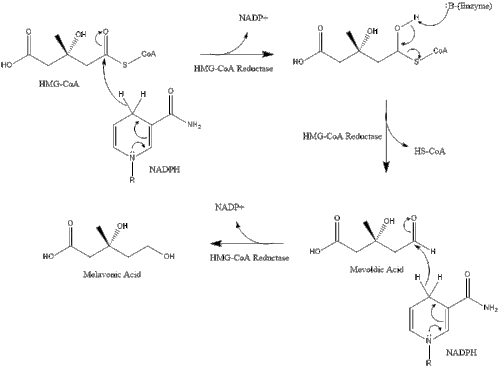
Синтез у тілі починається з мелавонатного шляху, в якому дві молекули ацетилу-КоА конденсується задля формування ацетоацетилу-КоА. За цим слідує друга конденсація між ацетилом-КоА та ацетоацетилом-КоА для формування 3-гідрокси-3-метилглютарилу-КоА.
Ця молекула потім відновлюється до мевалонату 3-гідрокси-3-метилглютарил-КоА редуктазою. Вироблення мевалонату є обмежуючим та незворотнім кроком у синтезі холестеролу, а також місцем дії статинів (клас холестерол-знижуючих препаратів).
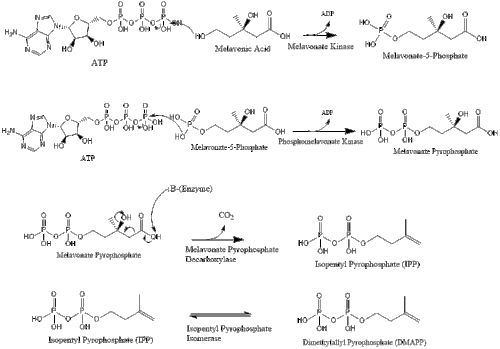
Потім мелавонат перетворюється на ізопентенилпірофосфат через два кроки фосфорилювання та один крок декарбоксилювання, який потребує АТФ.
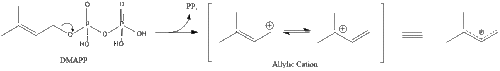
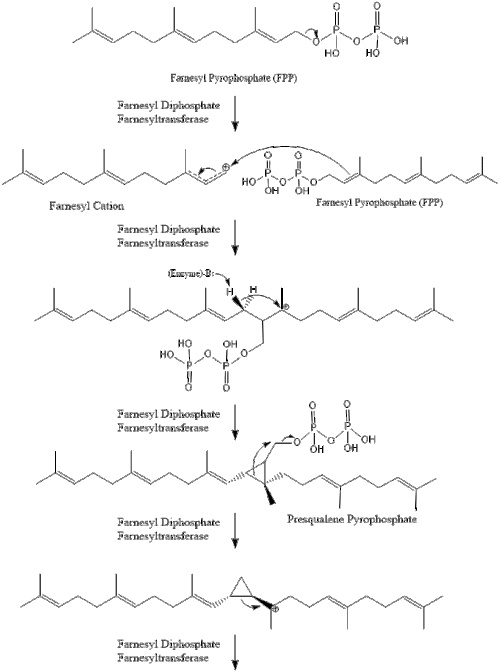
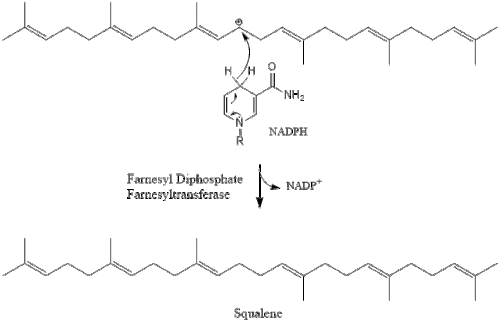
Три молекули ізопентенилпірофосфату конденсуються для формування фарнезилпірофосфату за допомогою дії of геранилтрансферази.
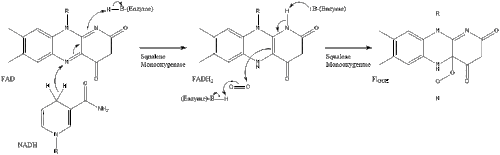
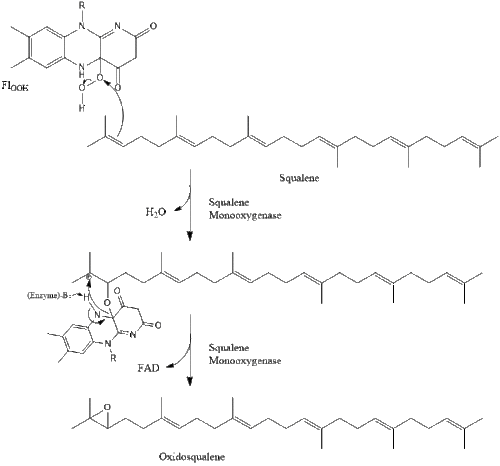
Дві молекули фарнезилпірофосфат потім конденсуються для формування сквалену за допомогою дії скваленсинтази в ендоплазматичному ретикулумі.
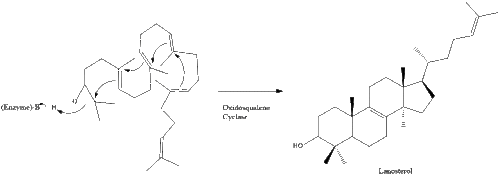
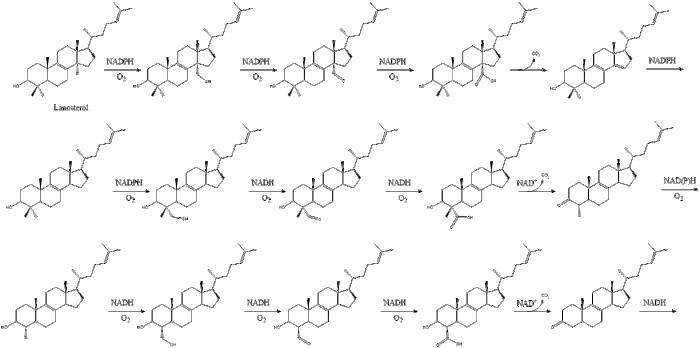
Оксидоскваленциклаза потім циклізує сквален для формування ланостеролу.
Під кінець, ланостерол перетворюється на холестерол через один із двох шляхів: шлях Блоха або шлях Кандуч-Рассел. Фінальні 19 кроків для формування холестеролу задіюють NADPH та кисень для окиснення метильних груп задля вилучення вуглецю, мутази для переміщення алкенових груп, та NADH задля відновлення кетонів.
Конрад Блох і Феодор Лінен розділили Нобелівську премію з фізіології або медицини 1964 року за їхні відкриття щодо деяких механізмів та методів регуляції холестеролу та метаболізму жирних кислот.
Регуляція
Обмежувальним є другий етап синтезу холестеролу, етап відновлення 3-гідрокси-3-метилглутарилу-КоА з утворенням мевалонату. Реакція каталізується ГМГ-редуктазою (відновлювальним ферментом). Накопичення холестеролу як кінцевого продукту анаболічного шляху за принципом негативного зворотного зв'язку зменшує швидкість його утворення.
Біотрансформація холестеролу
В організмі холестерол зазнає біотрансформації, численних метаболічних перетворень. Цей процес забезпечує синтез стероїдних сполук та забезпечує умови для екскреції надлишків стеролу. Першим етапом біотрансформації холестеролу є утворення його етерів з вищими карбоновими кислотами.
Література
- Губський Ю. Біологічна хімія. — Київ-Тернопіль : Укрмедкнига, 2000. — 508 с. — ISBN 966-7364-41-0.
- Гонський Я., Максимчук Т., Калинський М. Біохімія людини. — Тернопіль : Укрмедкнига, 2002. — 744 с. — ISBN 966-7364-17-8.