Хіральність
Хіра́льність, кіра́льність (від грец. χέρι — рука) — здатність відповідного об'єкта мати своє дзеркальне відбиття, не тотожне оригіналу. Інакше кажучи, об'єкт і його дзеркальне відбиття не можуть бути суміщені тільки обертанням і лінійним переміщенням; відсутність симетрії правої і лівої сторони об'єкта.
Протилежним явищем є ахіральність.
Зміст
Загальний опис
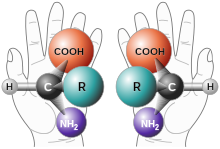
Наочним прикладом хірального об'єкта є права та ліва руки, звідси й назва поняття «хіральність». Права рука в дзеркалі відображається як ліва.
Хіральність — одне з фундаментальних понять стереохімії, але не тільки. Термін використовують також у математиці, фізиці тощо; там деколи вживають синонім — диссиметрія.
Хіральні молекули також називають оптично активними, оскільки вони по різному взаємодіють із поляризованим світлом. Однакові за хімічним складом та структурою молекули, які відрізняються хіральністю, що проявляється у протилежному напрямку обертання площини поляризації світла, називають енантіомерами. Оптичну активність історично пов'язували із асиметрією молекули, тобто із відсутністю елементів симетрії. Але хіральною може бути й молекула, яка має вісь симетрії. Приміром, молекула D- або L-винної кислоти в одній із конформацій має вісь симетрії другого порядку. Приклади хіральних плоских зображень із поворотною симетрією надають трискеліон і свастика.
Елементи хіральності
Виділяють кілька типів структурних елементів, наявність яких в молекулі надає їй властивість хіральності.
Хіральний центр
(англ. chirality centre)
- 1. Структурна одиниця молекули, що зумовлює виникнення оптичної активності.
- 2. Атом у молекулі, що спричиняє її хіральність.
Синоніми — стереогенний центр, центр хіральності.
Хіральний центр часто називають асиметричним атомом або, в фізиці, оптичним центром. Найбільш розповсюджений хіральний елемент. Зазвичай це атом карбону, поєднаний із чотирма різними замісниками. Але таким центром можуть бути й інші атоми (силіцію, фосфору, сульфуру тощо) з тетраедричним розташуванням замісників навколо них, причому в окремих випадках замісників лише три, а четверту вершину тетраедру займає неподілена електронна пара. Трапляються навіть ще складніші ситуації. В енантіомерних похідних адамантану хіральний центр розташований всередині молекули (геометричний центр каркаса, позначений зірочкою), в тій точці, де атома немає взагалі. Номінально така молекула містить 4 асиметричних атоми карбону, але насправді вона існує у вигляді лише двох просторових ізомерів замість 4² = 16; це відбувається тому, що стереохімія кожного із «чотирьох асиметричних атомів» фіксована, зв'язок із замісником не може бути спрямований всередину карбонового каркаса.
Координаційне число, більше від 4
Цікаво, що властивість хіральності притаманна навіть такому начебто простому об'єкту, як гральний кубик. Кількість варіантів розташування замісників навколо центру зростає із ростом координаційного числа, тож у координаційній хімії поняття хіральності також відіграє суттєву роль. Особливість комплексних сполук полягає в їхній суттєво нижчій стійкості до обміну лігандів; розповсюдженим є випадок, коли енантіомери легко перетворюються один в одного у розчині. Один із найпростіших прикладів хіральності для координаційного числа 6 дає комплекс із дипіридилом.
Вісь хіральності
Цей тип пов'язаний із наявністю у структури направленої дзеркально-поворотної осі. Такий елемент симетрії, як дзеркально-поворотна вісь, дозволяє поворот на відповідний кут у будь-який бік, і його наявність гарантує відсутність хіральності. «Направленість» цієї осі означає, що поворот дозволено лише в один бік, певний для кожного з енантіомерів. При типовому для атомів карбону координаційному числі 4 така вісь має четвертий порядок. Найпростішим прикладом є дизаміщені пропадієни. Інші можна знайти серед спіро-сполук. Складнішим прикладом є дизаміщені дифеніли (неплоскі внаслідок відштовхування замісників X та Y), це ще й ілюстрація атропоізомерії — просторової ізомерії, спричиненої неможливістю обертання навколо простого зв'язку (тут це зв'язок між бензеновими кільцями).
Площина хіральності
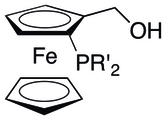
Визначається невідповідністю правого і лівого боку структури, в якої задано верх і низ (як-от жук із вусиками різної довжини). З'являється, приміром, у дизаміщеному фероцені; замісники можуть бути будь-якими, але різними і в одному кільці. Визначальним структурним елементом, що може бути основою для віднесення конфігурації молекули до певного різновиду, є площина. Така хіральність притаманна молекулам точкових груп С1, С2, D2.
Елемент хіральності
Загальна назва для осі хіральності, площини хіральності чи центра хіральності.
Спіральність
Будь-яка спіраль (точніше кажучи, гвинтова лінія) є хіральною, оскільки може бути правою або лівою. Найпростіша ілюстрація — це гексагеліцен, всі атоми карбону якого не можуть розміститися в одній площині внаслідок відштовхування атомів гідрогену крайніх кілець, тож утворюють спіраль (до речі, ця молекула також має вісь симетрії другого порядку). Спіральність має особливе значення для біохімії, вона притаманна пептидам, нуклеїновим кислотам тощо. Абсолютна конфігурація спіральних систем визначається тільки тим, в яку сторону вони закручені, та не залежить від їх будови.
Топологічна хіральність
Зумовлена топологією просторового розташування або одного ланцюга (вузол), або кількох поєднаних елементів.
Властивість хімічної частинки, пов’язана з наявністю в ній псевдохірального центра, осі або площини псевдохіральності.
Див. також
- Багато хіральних картинок можна знайти тут в підкатегоріях нижчих (до 10) ступенів
- Діастереомери
- Дистомер
- Діастереотопія
- Декартова система координат#Орієнтація осей
- Парність (фізика)
- Псевдохіральність
- Хіральний каталізатор
- Хіральний розчинник
- Асиметрична індукція
- Хіральність (математика)
- Хіральність (фізика)
- Закон хіральної чистоти
Джерела
- Потапов В.М. Стереохимия: Учеб. пособие для вузов. — 2-е изд., перераб. и доп. — М. : Химия, 1988. — ISBN 5-7245-0376-X.(рос.)
- Хиральность // Химическая энциклопедия : в 5 т. / гл. ред. Н. С. Зефиров. — М. : Большая Рос. энцикл., 1998. — Т. 5 : Триптофан — Ятрохимия. — Стб. 527. — Библиогр. в конце ст. — ISBN 5-85270-310-9.(рос.)