Гостра промієлоцитарна лейкемія
| Гостра промієлоцитарна лейкемія | |
|---|---|
|
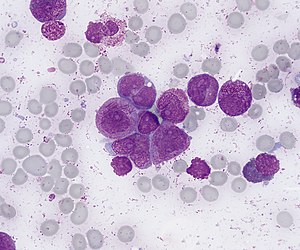
Мазок кісткового мозку при промієлоцитарному лейкозі. Забарвлення за Романовським, 1000х
| |
| Спеціальність | Онкологія, гематологія |
| Препарати | третиноїн, арсен, оксид арсену(III), метотрексат і Ідарубіцин |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | XH1A50 |
| МКХ-О | 9866/3 |
| OMIM | 612376 |
| DiseasesDB | 34779 |
| MeSH | D015473 |
| SNOMED CT | 28950004 |
| | |
Гостра промієлоцитарна лейкемія (ГМЛ М3, ГПЛ; англ. APML, APL) — один із підвидів гострої мієлоїдної лейкемії (ГМЛ), субстратом якої виступають малігнізовані незрілі гранулоцити — промієлоцити. Даний вид лейкемії охарактеризований в 1957 році Лейфом К. Хіллстедом на основі опису трьох клінічних випадків "специфічної лейкемії".
Зміст
Епідеміологія
Частота захворюваності коливається в широких межах в залежності від вікової групи та расової приналежності. Частка ГПЛ серед усіх гострих мієлоїдних лейкемій складає 3-9% у дітей та 10-15% у дорослих, з переважанням у віковому діапазоні 20-50 років. Найбільш висока частота цього типу лейкемії спостерігається у латиноамериканців. Так, наприклад, у Нікарагуа більш, ніж 50% усіх діагностованих ГМЛ у дітей припадає саме на ГПЛ. В інших країнах Латинської Америки цей показник наближується до 30%. В окремих регіонах Китаю частота ГПЛ сягає 32%.
Симптоми
Клінічні симптоми ГПЛ можуть відрізнятися у різних пацієнтів. Найбільш поширеними клінічними проявами є:
- Геморагічний синдром (80-90%), що часто є непропорційним до ступеню тромбоцитопенії. Дослідження вказують, що в основі ГПЛ пов’язаного геморагічного синдрому лежить підвищення швидкості фібринолізу.
- Лихоманка (15-30%)
- Анемія
- Тромбоцитопенія
- Лейкопенія
Менш поширеними симптомами є:
- Лейкоцитоз (найчастіше при гіпогранулярному морфологічному типі ГПЛ — M3v)
- Органомегалія
- Аденомегалія
- Лейкемічна інфільтрація ЦНС
- Лейкемічна інфільтрація шкірних покривів
Лабораторна діагностика
Лабораторна диференціація ГПЛ включає в себе морфологічне, цитохімічне, цитометричне, генетичне дослідження кісткового мозку, крові та ліквору.
Морфологія
Для постановки діагнозу гостра промієлоцитарна лейкемія у кістковому мозку хворого має бути виявлено >25% злоякісних клітин (бластів). Слід розрізняти випадки ГПЛ з класичною морфологією (М3) та гіпогранулярний підвид ГПЛ (М3v).
Класичний варіант має гіпергранулярні промієлоцити, деякі з яких містять палички Ауера. У окремих промієлоцитах азурофільна гранулярність повністю заміщена паличками Ауера, формуючи так звані faggot cells. Наявність даних включень дає цитоплазмі вигляд в'язки із хмизом, чим і зумовлена їх назва. Також у клітинах присутня характерна для промієлоцитів груба гранулярність. Ядро дволопатеве, але через гіперзернистість це може бути малопомітним.
Для гіпогранулярного/мікрогранулярного варіант ГПЛ (М3v) також характерні дволопатеві ядра. Часто між лопатями ядра виявляється розмите зображення, котре представляє собою зону апарату Гольджі, що містить гранули нижче рівня роздільної здатності світлового мікроскопа. Ретельний пошук може виявити деякі клітини, що містять гіпергранулярність або палички Ауера.
Цитохімія
Для диференціації ГПЛ може використовуватися широкий спектр цитохімічних досліджень. Найбільш поширеними є:
- Реакція на кислу фосфатазу — слабка
- Реакція забарвлення Суданом чорним — слабка/помірна
- Реакція із Шифф-йодною кислотою (PAS-реакція) — дифузне забарвлення цитоплазми
- Реакція на виявлення мієлоперокидази (POX-реакція) — помірна/виражена
- Реакція на виявлення неспецифічної естерази — слабка, часто може бути негативною
Проточна цитометрія
ГПЛ характеризується високоспецифічним імунофенотипом, який можна проаналізувати за допомогою проточної цитометрії. Фенотип характеризується відсутністю або дуже низькою експресією CD15, CD11a, CD11b, CD11c, CD18 (b-субодиниця CD11a, b, c), CD66b і CD66c. CD34 і людський лейкоцитарний антиген HLA-DR часто відсутні. Клітини часто позитивні щодо CD13, CD33, CD64, CD117.
ГПЛ M3v характеризується помірною експресією CD45. Клітини в цьому варіанті позитивні на CD2 , CD4, CD13, CD33, CD34 і CD117, тоді як HLA-DR, CD10, CD11b і CD11c завжди негативні.
Цитогенетика
Вирішальну роль в діагностиці ГПЛ відіграє цитогенетичне дослідження. Генетичною ознакою гострого промієлоцитарного лейкозу є збалансована реципрокна транслокація t(15;17) (q24;q21), що призводить до злиття генів промієлоцитарного лейкозу (PML) і рецептора ретиноєвої кислоти альфа (RARα). Злитий ген призводить до утворення химерного онкобілка PML-RARα, який відіграє причинну роль у патогенезі ГПЛ, порушуючи мієлоїдну диференціацію. t(15;17) присутня майже у всіх випадках морфологічно визначених ГПЛ, тоді як незначна меншість випадків містить варіантні транслокації, які зазвичай включають RARα та партнерські гени, відмінні від PML.
| Продукт злиття | Каріотип | Частота | Наявність реципрокного продукту | Чутливість до ATRA |
|---|---|---|---|---|
| PML-RARα | t(15;17)(q22;q11-21) | >99% | Так (75%) | Так |
| PLZF-RARα | t(11;17)(q23; q11-21) | ~20 випадків | Так | Ні |
| NPM-RARα | t( 5;17)(q32; q11-21) | 3 випадки | Так | Так |
| NuMA-RARα | t(11;17)(q13; q11-21) | 1 випадок | Ні | Так |
| STAT5b-RARα | t(17;17)(q11-21;q11-21) | 2 випадки | Ні | Ні |
Прогноз та терапія
Загалом, гостра промієлоцитарна лейкемія має сприятливий прогноз. До терапевтичних заходів, на сьогоднішній день, належать застосування комбінацій транс-ретиноєвої кислоти (ATRA), триоксиду арсену (ATO), хіміотерапії та, в окремих випадках, пересадка гемопоетичних стовбурових клітин.
На момент опису ГПЛ вважалася фатальною хворобою з медіаною виживаності менш, ніж тиждень. Із застосуванням неспецифічної хіміотерапії, відсоток довготривалої виживаності досягав рівня >50%. Переломним моментом у терапії ГПЛ стало застосування на рубежі 80-х та 90-х років ХХ століття препаратів на основі транс-ретиноєвої кислоти, що дозволило підвищити відсоток трьохрічної виживаності до 90% та більше..
Індукційна терапія
Високий ризик на початкових стадіях лікування становить ГПЛ-пов'язаний геморагічний синдром. Багато тих, хто не вижив, померли на ранніх стадіях хвороби до або під час індукційної хіміотерапії від ускладнень кровотечі (більшість від крововиливу в мозок). Сучасна індукційна терапія передбачає використання комбінації ATRA та ATO, котрі значно покращили результати у порівнянні із застосуванням монокомпонентної терапії. Згідно з дослідженнями, терапія першої лінії на основі ATRA та ATO без хіміотерапії може вилікувати майже всіх пацієнтів із низьким або нормальним рівнем лейкоцитів, має мінімальну токсичність і може вважатися новим стандартом лікування пацієнтів із низьким або середнім ризиком. Однак, якщо лейкоцити підвищуються вище 5000/мкл після початку прийому ATRA у пацієнта з низьким або проміжним ризиком, тоді слід ввести антрациклін або гідроксисечовину для зменшення лейкоцитів, що може полегшити коагулопатію та запобігти синдрому диференціації APL. Нарешті, пацієнти з ГПЛ високого ризику дійсно отримують користь від принаймні короткого курсу інтенсивної хіміотерапії під час індукції (+/− консолідація) і, можливо, також 1–2 роки підтримуючої терапії.
Синдром ретиноєвої кислоти
Після початку терапії ATRA пацієнти повинні перебувати під ретельним наглядом щодо розвитку синдрому ретиноєвої кислоти, котрий проявляється лихоманкою, збільшенням ваги, респіраторним дистресом із рентгенографічними ознаками інтерстиціальних інфільтратів або без них, перикардіальним та плевральним випотами, епізодичною артеріальною гіпотензією і гострою нирковою недостатністю. Як правило, синдром виникає між другим днем і третім тижнем терапії ATRA, із захворюваністю від 5% до 27% і смертністю (тих, у кого розвивається) від 5% до 29%.
Консолідація
Метою консолідуючої терапії є молекулярна ремісія, яка визначається за негативним ПЛР-статусом, оскільки вона переконливо корелює з кращим результатом. Консолідація ATRA/ATO після індукції ATRA/ATO забезпечує чудові результати у пацієнтів із низьким або середнім ризиком. Таким чином, у пацієнтів із лейкоцитами ≤10 000/мкл, які не мають протипоказань до АТО, консолідаційний підхід, що не ґрунтується на хіміотерапії (як при індукції), можна вважати новим стандартом лікування. У пацієнтів із високим ризиком комбінація ATRA/ATO з ідарубіцином для індукції з наступною консолідацією ATRA/ATO без хіміотерапії продемонструвала дуже сприятливі результати і зазвичай вважається схемою вибору для цих пацієнтів. Альтернативно, курс ATRA та ідарубіцин окремо (без ATO) для індукції з подальшою проміжною дозою цитарабіну в якості першої консолідації також є ефективною стратегією лікування і може використовуватися у пацієнтів з високим ризиком. Хоча цитарабін, як видається, приносить користь пацієнтам із високим ризиком, якщо його включати до схем на основі ATRA та антрациклінів, його роль у комбінації з ATO, якщо така є, невідома.
Підтримуюча терапія
Роль підтримуючої терапії у пацієнтів з низьким або проміжним ризиком, які отримують індукцію та консолідацію на основі ATRA/ATO без хіміотерапії, не повністю відома. Пацієнтам із високим ризиком зазвичай рекомендується підтримуюча стратегія на основі ATRA, що включає низькі дози 6-меркаптопурину та пероральний метотрексат (з ретельним моніторингом формули крові, особливо у літніх пацієнтів) протягом 1–2 років залежно від переносимості. У міру подальшого розвитку підходів до мінімізації або виключення хіміотерапії зі схем APL підтримуюча терапія, ймовірно, продовжуватиме відігравати важливу роль у пацієнтів із групою високого ризику або стійкою MRD. І навпаки, додавання АТО до стратегій індукції та консолідації на передньому плані, здається, позбулося необхідності підтримуючої терапії у неускладнених пацієнтів із низьким або проміжним ризиком.