Інженерія нервової тканини
Інженерія нервової тканини (або нейротканинна інженерія) — це галузь тканинної інженерії, яка зосереджена на розробці функціональних замінників нервової тканини для заміни або відновлення пошкодженої або хворої тканини центральної нервової системи (ЦНС) або периферичної нервової системи (ПНС). Метою інженерії нервової тканини є відновлення втраченої функції нервової системи за допомогою побудови нової нервової тканини із спеціальних матеріалів, клітин і факторів росту, для транплантування в місця дефекту.
Ця область дослідження включає в себе принципи матеріалознавства, біології та інженерії для проектування та розробки пристроїв, каркасів і 3D-культур, які сприяють росту, виживанню та функціональній інтеграції нейронів і гліальних клітин. Деякі із застосувань нейротканинної інженерії включають лікування травм спинного мозку, черепно-мозкових травм, інсульту, хвороби Паркінсона та інших станів, які призводять до пошкодження нервової системи чи її вікової дегенерації.
Розвиток нейротканинної інженерії потребує міждисциплінарного підходу, який передбачає співпрацю між інженерами, неврологами та клініцистами для перетворення лабораторних результатів у клінічне застосування.
Зміст
Огляд
Нервова система поділяється на два відділи: ЦНС і ПНС. ЦНС складається з головного та спинного мозку, тоді як ПНС складається з нервів, які походять від головного та спинного мозку та іннервують решту тіла.
Потреба в інженерії нервової тканини, як окремої галузі, виникає через складність нервових клітин і нервової тканини відновлюватися самостійно після пошкодження нервової системи. ПНС має певну, але обмежену регенерацію нервових клітин. Було виявлено, що нейрогенез дорослих стовбурових клітин у ЦНС відбувається в гіпокампі, субвентрикулярній зоні (SVZ) і спинному мозку. Дослідження 2020-го року показало також нейрогенез у дорослих у інших зонах мозку, зокрема вгіпоталамусі, смугастому тілі, чорній субстанції, корі головного мозку та мигдалині.
Пошкодження ЦНС можуть бути викликані інсультом, нейродегенеративними розладами, травмою або енцефалопатією. Нині досліджуються кілька методів лікування пошкоджень ЦНС:
- імплантація стовбурових клітин безпосередньо в місце пошкодження
- доставка морфогенів до місця пошкодження
- вирощування нервової тканини in vitro з нейронними стовбуровими або клітинами-попередниками в 3D каркасі.
Запропоноване використання електропрядених полімерних волокнистих каркасів для нейронних субстратів відновлення датується щонайменше 1986 роком у заявці NIH SBIR від Simon.
Для ПНС відірваний нерв можна повторно з’єднати та повторно іннервувати за допомогою трансплантатів або спрямування існуючого нерва через канал.
Нещодавні дослідження створення мініатюрної кори головного мозку, відомої як кортикопоез, і моделей мозку, відомих як церебральні органоїди, є методами, які можуть сприяти розвитку регенерації нервової тканини. Природні кортикальні попередники кортикопоезу — це нервові тканини, які можуть бути ефективно вбудовані в мозок.
Церебральні органоїди — це тривимірні плюрипотентні стовбурові клітини людини, розвинені в секції кори головного мозку, що свідчить про наявність потенціалу для ізоляції та розвитку певних нервових тканин за допомогою нейронних попередників.
Дослідження 2023 року показало, що органоїди людського мозку успішно інтегруються із зоровою системою дорослого щура після трансплантації у великі пошкоджені порожнини зорової кори.
Іншою ситуацією, що вимагає імплантації чужорідної тканини, є використання записуючих електродів. Хронічні електродні імплантати – це інструмент, який використовується в дослідницьких програмах для запису сигналів із областей кори головного мозку . Дослідження стимуляції нейронів ПНС у пацієнтів з паралічем і протезуванням може розширити знання про реіннервацію нервової тканини як у ПНС, так і в ЦНС. Це дослідження здатне зробити один складний аспект інженерії нервової тканини — функціональну іннервацію нервової тканини — більш керованою.
Центральна нервова система (ЦНС)
Причини ураження ЦНС
Є три основні причини ураження ЦНС: інсульт, черепно-мозкова травма (ЧМТ) або ускладнення розвитку. Інсульти класифікуються як геморагічні (коли судина пошкоджена до ступеня крововиливу в мозок) або ішемічні (коли тромб блокує кровотік через судину в мозку). Коли відбувається крововилив, кров просочується в навколишні тканини, що призводить до відмирання тканин, тоді як ішемічні крововиливи призводять до відсутності кровотоку до певних тканин. Черепно-мозкова травма викликається зовнішніми силами, що впливають на череп або спинний мозок. Проблеми з розвитком ЦНС призводять до аномального росту тканин під час розвитку, таким чином знижуючи функцію ЦНС.

Лікування та дослідження ЦНС
Імплантація стовбурових клітин на місце пошкодження
Один із потенційних методів лікування ураження ЦНС включає культивування стовбурових клітин in vitro та імплантацію їх у місце ураження мозку. Імплантація стовбурових клітин безпосередньо в місце пошкодження запобігає утворенню гліальних рубців і сприяє нейрогенезу, що походить від пацієнта, але також створює деякі ризики — ризик розвитку пухлини, запалення та міграції стовбурових клітин з місця пошкодження. Пухлиноутворення може виникнути через неконтрольований характер диференціації стовбурових клітин, запалення може виникнути через відторгнення імплантованих клітин клітинами-господарями, а висока міграційна природа стовбурових клітин призводить до того, що клітини віддаляються від місця пошкодження, тому не надає бажаний вплив на місце пошкодження.
Інші проблеми інженерії нервової тканини включають створення безпечних джерел стовбурових клітин і отримання відтворюваних результатів від лікування до лікування.
Крім того, ці стовбурові клітини можуть діяти як носії для інших методів лікування, хоча позитивні ефекти використання стовбурових клітин як механізму доставки не підтверджені. Пряма доставка стовбурових клітин має підвищений корисний ефект, якщо вони запрограмовані як нейронні клітини in vitro.
Доставка молекул до місця пошкодження
Молекули, які сприяють регенерації нервової тканини, включаючи фармацевтичні препарати, фактори росту, відомі як морфогени, і мікроРНК також можуть бути безпосередньо введені в місце пошкодження пошкодженої тканини ЦНС.
Нейрогенез спостерігався також у тварин, яких лікували психотропними препаратами, через пригнічення зворотного захоплення серотоніну та індукцію нейрогенезу в мозку.
Коли стовбурові клітини диференціюються, клітини виділяють морфогени, такі як фактори росту, щоб сприяти здоровому розвитку. Ці морфогени допомагають підтримувати гомеостаз і нейронні сигнальні шляхи, і вони можуть бути доставлені в місце пошкодження для сприяння росту пошкоджених тканин. В даний час доставка морфогену має мінімальні переваги через взаємодію морфогенів з ушкодженою тканиною. Щоб лікування було ефективним, морфогени повинні бути присутніми в місці пошкодження в певній і постійній концентрації.
Було також показано, що мікроРНК впливає на нейрогенез, керуючи диференціюванням недиференційованих нейронних клітин.
Цілеспрямована реіннервація
Цілеспрямована реіннервація (Targeted reinnervation) — це метод реіннервації нейронних зв’язків у ЦНС та ПНС, зокрема у паралізованих пацієнтів та осіб з ампутованими кінцівками, які використовують протези кінцівок. Зараз досліджуються пристрої, які сприймають і записують електричні сигнали, що поширюються через нейрони у відповідь на намір людини рухатися. Це дослідження може пролити світло на те, як реіннервувати нейронні зв’язки між розірваними нервами ПНС і зв’язки між пересадженими 3D каркасами в ЦНС.
Імплантація нервової тканини, розробленої in vitro
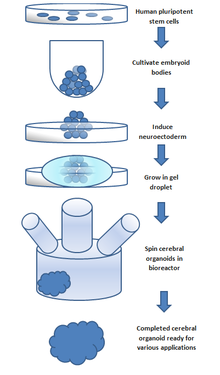
Третій метод лікування пошкоджень ЦНС полягає у штучному створенні тканини поза тілом для імплантації в місце пошкодження. Цей метод може лікувати травми, які складаються з великих порожнин, де більша кількість нервової тканини потребує заміни та регенерації. Нервова тканина вирощується in vitro з нейронними стовбуровими клітинами або клітинами-попередниками в 3D каркасі, утворюючи ембріоїдні тіла. Ці ембріоїдні тіла складаються зі сфери стовбурових клітин, де внутрішні клітини є недиференційованими нервовими клітинами, а навколишні клітини стають все більш диференційованими. Тривимірні каркаси використовуються для трансплантації тканини до місця пошкодження та створення відповідного інтерфейсу між штучною та тканиною мозку.
Каркаси мають бути: біосумісними, біологічно розкладаними, відповідати за розміром та формою місцю пошкодження, подібними до існуючої тканини за еластичністю та жорсткістю та підтримувати зростання клітин і тканин.
Поєднання використання спрямованих стовбурових клітин і каркасів для підтримки нервових клітин і тканин збільшує виживання стовбурових клітин у місці пошкодження, підвищуючи ефективність лікування.
Існує 6 різних типів каркасів, які досліджуються для використання в цьому методі лікування ушкоджень нервової тканини:
- Рідкі гідрогелі — це зшиті гідрофобні полімерні ланцюги, в яких нейронні стовбурові клітини вирощуються на поверхні гелю або інтегруються в гель під час зшивання полімерних ланцюгів. Основним недоліком рідких гідрогелів є обмежений захист клітин, які трансплантуються.
- Підтримуючі каркаси (Supportive scaffolds) — виготовлені з твердих кулькоподібних або мікропористих структур і можуть діяти як носії для трансплантованих клітин або факторів росту, які стовбурові клітини виділяють під час диференціювання. Клітини прилипають до поверхні матриці двовимірними шарами. Підтримуючі каркаси легко трансплантуються в місце пошкодження головного мозку через розміри скаффолдів. Вони забезпечують матрицю, що сприяє клітинній адгезії та агрегації, таким чином збільшуючи культуру здорових клітин.
- Каркаси для вирівнювання (Aligning scaffolds) — можуть бути на основі шовку, полісахаридів або на основі інших матеріалів, таких як багатий колагеном гідрогель. Ці гелі тепер покращені мікровізерунками на поверхні для сприяння розвитку нейронних відростків. Ці каркаси в основному використовуються для регенерації, яка має відбуватися в певній орієнтації, наприклад, при травмах спинного мозку.
- Інтегративні каркаси — в основному використовуються для захисту трансплантованих клітин від механічних пошкоджень, яким вони піддаються в процесі імплантації в місце пошкодження. Ці каркаси також зменшують ймовірність того, що запальні клітини, розташовані в місці пошкодження, мігрують у каркас зі стовбуровими клітинами. Помічено, що кровоносні судини проростають через каркас, таким чином каркас і клітини інтегруються в тканину господаря.
- Комбінація сконструйованих каркасів представляє варіант 3D-каркасу, який може мати як необхідні візерунки для адгезії клітин, так і гнучкість для адаптації до постійно мінливого середовища в місці пошкодження.
- Децелюляризовані каркаси ECM є варіантом для каркасів, оскільки вони більш точно імітують нативну тканину, але наразі ці каркаси можна зібрати лише з ампутацій і трупів.
Ці тривимірні каркаси можуть бути виготовлені за допомогою методів вилуговування частинок, газового спінювання, з’єднання волокон, лиття з розчинника або електроформування; кожна техніка створює каркас із властивостями, відмінними від інших технік.
Було показано, що успіх включення 3D каркасів у ЦНС залежить від стадії, на якій клітини диференціювалися. Пізніші стадії забезпечують більш ефективну імплантацію, тоді як клітини на більш ранніх стадіях повинні бути піддані впливу факторів, які змушують клітини диференціюватись і, таким чином, належним чином реагувати на сигнали, які клітини отримуватимуть у місці пошкодження ЦНС. Нейротрофічний фактор, отриманий з мозку, є потенційним кофактором для сприяння функціональній активації нейронів, отриманих з клітин ES, у місцях пошкодження ЦНС.
Периферична нервова система (ПНС)
Причини ураження ПНС
Травма ПНС може спричинити таке серйозне пошкодження, як розрив нерва, розщеплення нерва на проксимальну та дистальну частини. Дистальний нерв з часом дегенерує через бездіяльність, тоді як проксимальний кінець з часом набрякає. Дистальний кінець не дегенерує відразу, а набряк проксимального кінця не робить його нефункціональним, тому досліджуються методи відновлення зв’язку між двома кінцями нерва.
Лікування та дослідження ПНС
Хірургічне з'єднання
Одним із методів лікування пошкодження ПНС є хірургічне відновлення відірваного нерва шляхом взяття двох кінців нерва та їх зшивання. Під час зшивання нервів кожен пучок нерва знову з’єднується, з’єднуючи нерв разом. Хоча цей метод працює для розривів, які створюють невеликий проміжок між проксимальним і дистальним закінченнями нервів, цей метод не працює на проміжках більшої відстані через напругу, яку необхідно застосувати до нервових закінчень. Ця напруга призводить до дегенерації нерва, і тому нерв не може відновитися та сформувати функціональний нейронний зв’язок.
Пересадки тканин
Тканинні трансплантати використовують нерви або інші матеріали для з'єднання двох кінців відірваного нерва. Існує три категорії тканинних трансплантатів: трансплантати аутологічної тканини, трансплантати неавтологічної тканини та ацелюлярні трансплантати.
- Трансплантати аутологічної тканини пересаджують нерви з іншої частини тіла пацієнта, щоб заповнити проміжок між обома кінцями пошкодженого нерва. Ці нерви, як правило, є шкірними нервами, але й інші нерви були досліджені з обнадійливими результатами. Ці аутологічні нервові трансплантати є поточним золотим стандартом для трансплантації нервів ПНС через високу біосумісність аутологічних трансплантатів нервів, але існують проблеми щодо вилучення нерва у самих пацієнтів і можливості зберігати велику кількість аутологічних трансплантатів на майбутнє використовування.
- Неавтологічні та ацелюлярні трансплантати (включаючи матеріали на основі позаклітинного матриксу) — це тканини, які не походять від пацієнта, а можуть бути зібрані з трупів (відомі як алогенні тканини) або тварин (відомі як ксеногенні тканини). Хоча ці тканини мають перевагу перед аутологічними тканинними трансплантатами, оскільки тканину не потрібно брати у пацієнта, виникають труднощі з потенційною передачею захворювання та, отже, імуногенними проблемами. Наразі досліджуються методи усунення імуногенних клітин, залишаючи позаклітинно-матричні-компоненти тканини, щоб підвищити ефективність трансплантатів неаутологічної тканини.
Наведення
Методи керування регенерацією ПНС використовують нервові направляючі канали, щоб допомогти аксонам відновити правильний шлях, і можуть спрямовувати фактори росту, що виділяються обома кінцями нерва, для сприяння росту та повторному з’єднанню. Методи наведення зменшують утворення рубців на нервах, збільшуючи функціональність нервів для передачі потенціалів дії після повторного підключення. У керівних методах регенерації ПНС використовуються два види матеріалів: натуральні та синтетичні.
- Матеріали на натуральній основі – це модифіковані каркаси, що походять від компонентів позаклітинного матриксу і глікозаміногліканів. Ламінін, колаген і фібронектин, які є компонентами позаклітинного матриксу, направляють розвиток аксонів і сприяють нервовій стимуляції та активності. Інші молекули, які можуть сприяти відновленню нервів, це: гіалуронова кислота, фібриноген, фібринові гелі, самозбірні пептидні каркаси, альгінат, агароза та хітозан.
- Синтетичні матеріали забезпечують метод регенерації тканин, за допомогою якого можна контролювати хімічні та фізичні властивості трансплантата. Оскільки властивості матеріалу можуть бути визначені для ситуації, в якій він використовується, синтетичні матеріали є привабливим варіантом для регенерації ПНС. Використання синтетичних матеріалів пов’язане з певними проблемами, такими як: формування матеріалу трансплантата до необхідних розмірів, здатність до біологічного розкладання, стерилізація, стійкість до розривів, легкість у роботі, низький ризик інфікування та низька реакція на запалення завдяки матеріалу. Матеріал також повинен підтримувати канал під час регенерації нерва. В даний час найбільш часто досліджувані матеріали зосереджені на поліефірах, але також досліджуються біорозкладаний поліуретан, інші полімери та біорозкладне скло . Іншими можливостями для синтетичних матеріалів є електропровідні полімери та полімери, біологічно модифіковані для сприяння росту аксонів клітин і підтримки аксонного каналу.
Цілеспрямована реіннервація
Цілеспрямована реіннервація (Targeted reinnervation) — це метод реіннервації нейронних зв’язків у ЦНС та ПНС, зокрема у паралізованих пацієнтів та осіб з ампутованими кінцівками, які використовують протези кінцівок. Зараз досліджуються пристрої, які сприймають і записують електричні сигнали, що поширюються через нейрони у відповідь на намір людини рухатися. Це дослідження може пролити світло на те, як реіннервувати нейронні зв’язки між розірваними нервами ПНС і зв’язки між пересадженими 3D каркасами в ЦНС.
Пов'язані дослідження
Моделювання розвитку тканин мозку in vitro
Двома моделями розвитку тканин мозку є церебральні органоїди та кортикопоез.
Ці моделі забезпечують in vitro модель нормального розвитку мозку , але ними можна маніпулювати, щоб дослідити нейронні дефекти. Таким чином, дослідники можуть вивчати механізми здорового та неправильного розвитку за допомогою цих моделей. Ці тканини можна виготовити або з мишачих ембріональних стовбурових клітин (ЕСК), або з людських. Мишачі ЕСК культивують у білку, який називається 'інгібітор Sonic Hedgehog', щоб сприяти розвитку дорсального переднього мозку та вивчати долю кори. Показано, що цей метод створює аксональні шари, які імітують широкий спектр кортикальних шарів. Тканини, отримані з ЕСК людини, використовують плюрипотентні стовбурові клітини для формування тканин на каркасі, утворюючи людські ембріоїдні тіла. Ці тканини, отримані з ЕСК людини, утворюються шляхом культивування плюрипотентних ембріоїдних тіл людини в обертовому біореакторі.
Церебральні органоїди
Церебральні органоїди, також відомі як органоїди мозку, є тривимірними (3D) структурами, створеними з плюрипотентних стовбурових клітин людини. Такі органоїди нагадують людський мозок, що розвивається, з точки зору типів клітин, організації та функціональності. Церебральні органоїди здатні повторювати різні аспекти розвитку людського мозку, включаючи проліферацію нервових клітин-попередників, диференціацію нейронів, формування окремих ділянок мозку і навіть формування синапсів.
Ці органоїди зазвичай утворюються шляхом культивування плюрипотентних стовбурових клітин людини в 3D-матриці, яка сприяє утворенню нервових клітин-попередників, які диференціюються та самоорганізуються в різні типи клітин мозку. Церебральні органоїди широко використовуються в дослідженнях нейророзвитку для вивчення клітинних і молекулярних механізмів розвитку людського мозку та моделювання різних неврологічних розладів.
Використання церебральних органоїдів у дослідженнях має потенціал для значного вдосконалення нашого розуміння людського мозку та надання нових уявлень про розвиток і лікування неврологічних розладів.
Органоїдний інтелект
Органоїдний інтелект (ОІ) — це нова міждисциплінарна галузь, зосереджена на розробці біологічних обчислень із використанням 3D-культур клітин людського мозку (органоїдів мозку) і технологій інтерфейсу мозок-машина. Біобчислювальні системи на основі OI мають потенціал для швидшого прийняття рішень, безперервного навчання під час виконання завдань і більшої ефективності використання енергії та даних, ніж обчислення на основі кремнію та штучного інтелекту. Розвиток OI може покращити наше розуміння розвитку мозку, навчання, пам’яті та потенційно допоможе знайти лікування неврологічних розладів, таких як деменція.
OI включає збільшення органоїдів мозку в складні, міцні 3D-структури, збагачені клітинами та генами, пов’язаними з навчанням, підключення їх до пристроїв введення та виведення наступного покоління та систем ШІ/машинного навчання. Для цього потрібні нові моделі, алгоритми та технології інтерфейсу, щоб спілкуватися з органоїдами мозку, розуміти, як вони навчаються та обчислюють, а також обробляти та зберігати величезні обсяги даних, які вони генерують.
Дослідження in vivo
Трансплантація кортикальних стовбурових клітин показала багатообіцяючий потенціал для відновлення мозку. Однак ефективність сучасних моделей трансплантації в кодуванні корисної функції для хазяїна через отримані від трансплантації нейрони все ще обмежена. Це пояснюється відсутністю деяких типів клітин у трансплантатах, аномальними пропорціями типів клітин, аномальною цитоархітектурою та неефективною васкуляризацією.
Щоб усунути ці обмеження, була розроблена платформа трансплантації для тестування прототипів неокортикальної тканини. Платформа включала трансплантацію дисоційованих мишачих ембріональних теленцефальних клітин у рідкому каркасі в уражену аспірацією кору кори дорослої миші. Попередники донорських нейронів диференціювалися на нейрони верхнього та глибокого шарів, які демонстрували синаптичні точки, проектувалися за межі трансплантата у відповідні ділянки мозку, ставали електрофізіологічно активними протягом одного місяця після трансплантації та реагували на візуальні стимули. Інтернейрони та олігодендроцити були присутні в трансплантатах з нормальною щільністю. Трансплантати повністю васкуляризувалися через тиждень після трансплантації. Клітини також були організовані в шари. Ця платформа in vivo пропонує підтвердження концепції розробки та тестування прототипів тканин, схожих на неокорку, які можуть мати наслідки для відновлення мозку та регенеративної медицини.
Трансплантація органоїдів
Дослідження 2023 року показало, що органоїди людського мозку успішно інтегруються із зоровою системою дорослого щура після трансплантації у великі пошкоджені порожнини зорової кори. Транссинаптичне відстеження на основі вірусів виявило полісинаптичний шлях між трансплантованими людськими органоїдними нейронами та сітківкою щура-господаря, та взаємний зв’язок між трансплантатом та іншими регіонами зорової системи. Візуальна стимуляція тварин-господарів викликає відповіді в органоїдних нейронах, включаючи вибірковість орієнтації. Ці результати демонструють здатність органоїдів людського мозку приймати складні функції після введення у великі порожнини травми, пропонуючи трансляційну стратегію для відновлення функції після пошкодження кори.
Див.також
Література
Книги
- Advances in CNS Repair, Regeneration, and Neuroplasticity: From Basic Mechanisms to Therapeutic Strategies. / Li, Shuxin; Wu, Junfang; Tedeschi, Andrea, 2022 — Frontiers Media SA. ISBN 978-2-88974-633-0.
- Replacing Aging / Jean M Hébert Ph.D. / 2021 / ISBN 979-8577571191
- Principles of Tissue Engineering (5th Edition) / Роберт Ланца, Роберт Ленджер, Joseph P. Vacanti, Anthony Atala. / London, 2020. ISBN 978-0-12-821401-5.
Журнали
- Nature Biomedical Engineering
- Nature Biotechnology
- Bioengineering
- Frontiers in Bioengineering and Biotechnology
- The Journal of Bioscience and Bioengineering
- Nature Review Materials
Статті
- An In Vivo Platform for Rebuilding Functional Neocortical Tissue — Quezada A, Ward C, Bader ER, Zolotavin P, Altun E, Hong S, Killian NJ, Xie C, Batista-Brito R, Hébert JM. / 2023
- Structural and functional integration of human forebrain organoids with the injured adult rat visual system — Dennis Jgamadze, James T. Lim, Zhijian Zhang, Paul M. Harary et al. / 2023
- Neural tissue engineering: From bioactive scaffolds and in situ monitoring to regeneration — B. Gong et al. / 2022
- Tissue-Engineered Models of the Human Brain: State-of-the-Art Analysis and Challenges (review, pdf) — G. Tarricone et al. / 2022
- Potential Variables for Improved Reproducibility of Neuronal Cell Grafts at Stroke Sites — Krzyspiak J, Khodakhah K, Hébert JM. / 2022
- Biomaterials for Neural Tissue Engineering — L.R. Doblado et al. / 2021
- Neural activity promotes long-distance, target-specific regeneration of adult retinal axons. / Lim, J. H., Stafford, B. K., Nguyen, P. L., Lien, B. V., Wang, C., Zukor, K., He, Z., & Губерман Ендрю / Nature neuroscience, 19(8), 1073–1084.
Посилання
- Institute of Neural Regeneration & Tissue Engineering
- The Hébert Lab — Albert Einstein College of Medicine
Відео
- Can the damaged brain repair itself? — Siddharthan Chandran. TED [відео] / 2013
- Neural Tissue Engineering: How to Restore Structure and Function of 3D Neural Tissue? [відео] / 2021
- Nerve Guides as Nerve Tissue Engineering Biomaterials [відео] / 2021
- Present approaches for neural tissue regeneration: Neurostimspinal project [відео] / 2021